患有T细胞白血病和淋巴瘤(统称T细胞癌)的成年人存活时间较短,目前尚缺乏对这类疾病的靶向治疗。临床前研究表明,靶向T细胞受体β-链恒定区1(T cell receptor β-chain constant region 1,TRBC1)可以杀死癌变的T细胞,同时保留健康T细胞以维持免疫,所以TRBC1是治疗T细胞癌的重要靶点。
然而,AUTO4(一种TRBC1 CAR-T细胞疗法)的首次人体临床试验显示,该药物应答率低,且有无法解释的CAR-T细胞损失现象。
3月27日,一篇发表在Nature的论文显示,研究人员发现,CAR-T细胞是被患者的正常T细胞杀死的,所以降低了疗效。为了解决这个问题,他们开发了一种靶向TRBC1的ADC药物,可以在体外杀死TRBC1癌细胞,并在小鼠模型中治愈人类T细胞癌。TRBC1-ADC可能为靶向TRBC1提供最佳形式,并在T细胞癌患者中产生高效应答。
具体来说,研究人员首先证明了正常T细胞会杀死TRBC1 CAR-T细胞,反之亦然(双向杀伤)。
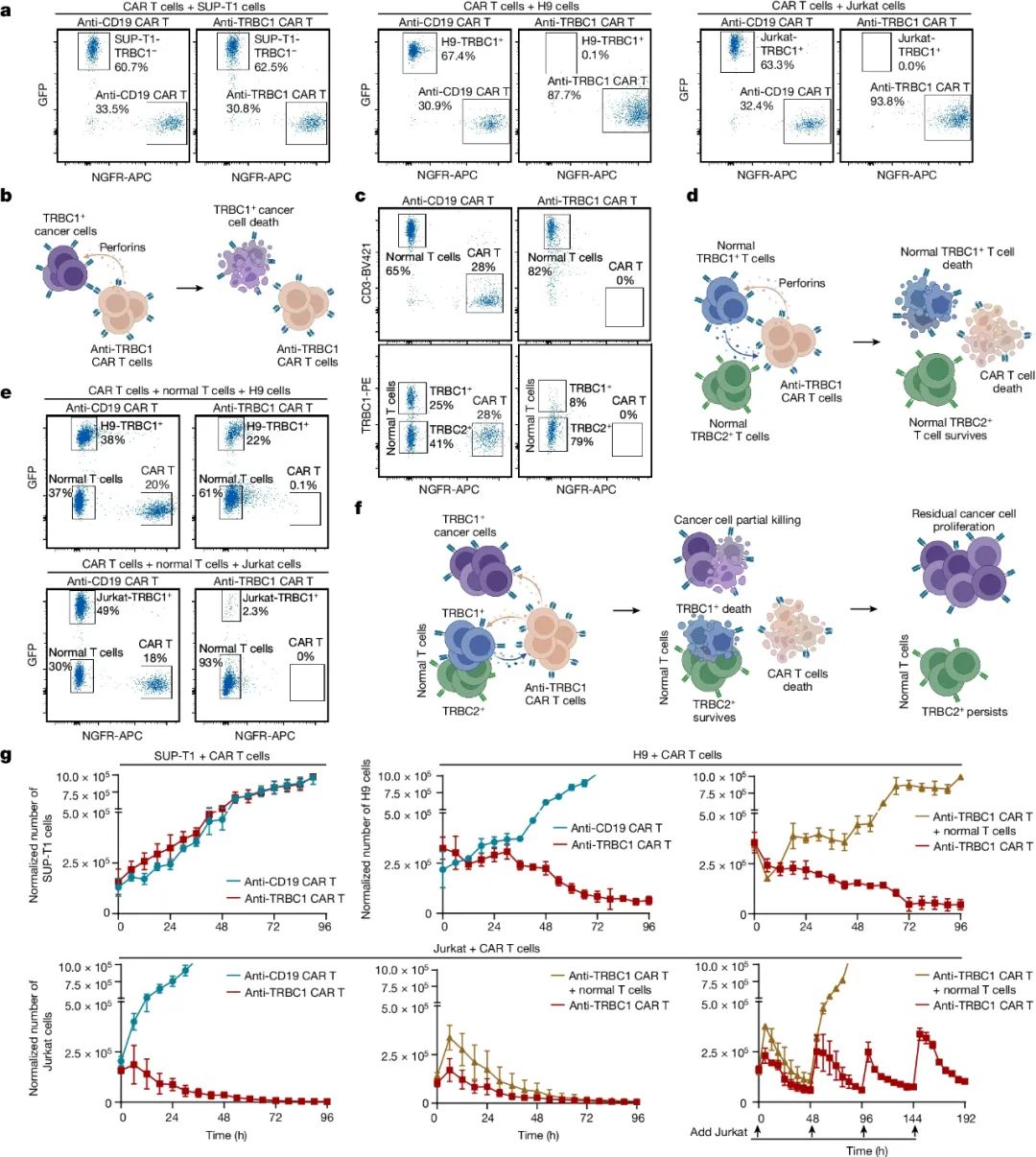
图1. 正常T细胞会杀死TRBC1 CAR-T细胞
接下来,研究人员想开发一种不同的策略,来靶向TRBC1杀死癌细胞。考虑到ADC可以通过内化并释放细胞毒药物杀死靶细胞,所以他们测试了抗TRBC1抗体在与T细胞上的TRBC1 TCR结合后是否也被内化。结果显示抗TRBC1抗体被转运到溶酶体中,可以用于给药。
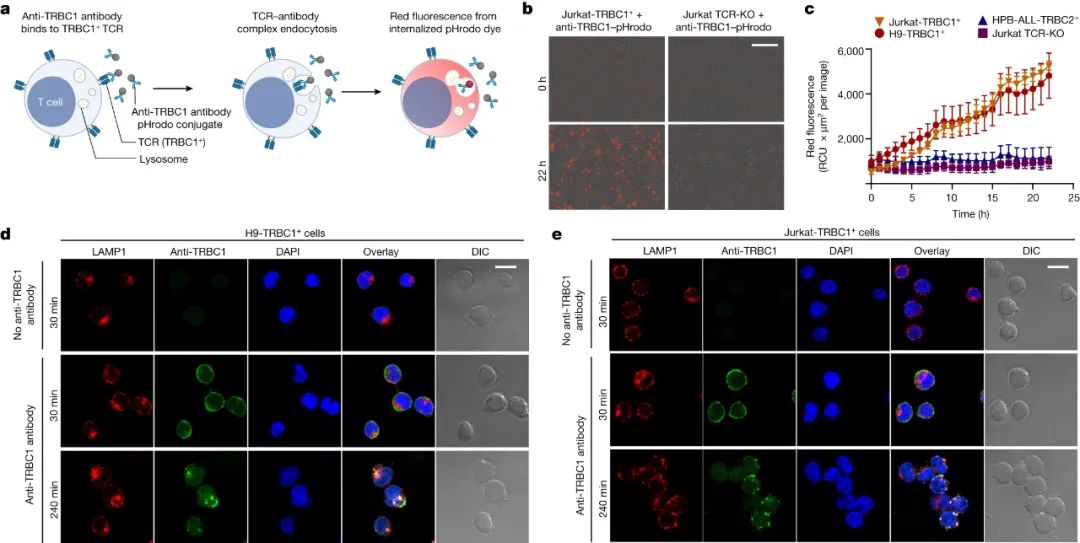
图2. 抗TRBC1抗体与TRBC1 TCR结合导致抗体内化至溶酶体
基于上述结果,研究人员将抗TRBC1抗体与细胞毒药物SG3249结合(SG3249作为有效载荷的安全性和有效性已经在临床试验中得到证实),得到了抗TRBC1–SG3249 ADC,数据显示,该ADC药物IC50与其他FDA批准的ADCs相当。
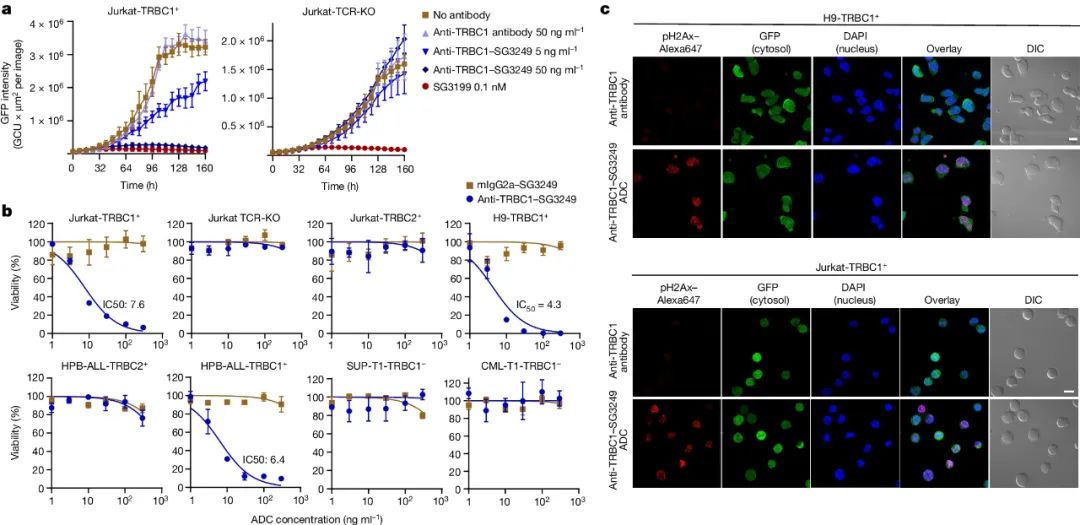
图3. 抗TRBC1–SG3249 ADC在体外的性能
此外,研究人员还测试该ADC在正常T细胞存在下杀死癌细胞的能力。结果显示,正常T细胞不影响ADC对三种TRBC1癌细胞系的毒性,且没有观察到对四种TRBC1+-癌细胞系的细胞毒性。此外,对正常T细胞TRBC1亚群有剂量依赖性细胞毒性,但对TRBC2亚群的毒性很小。
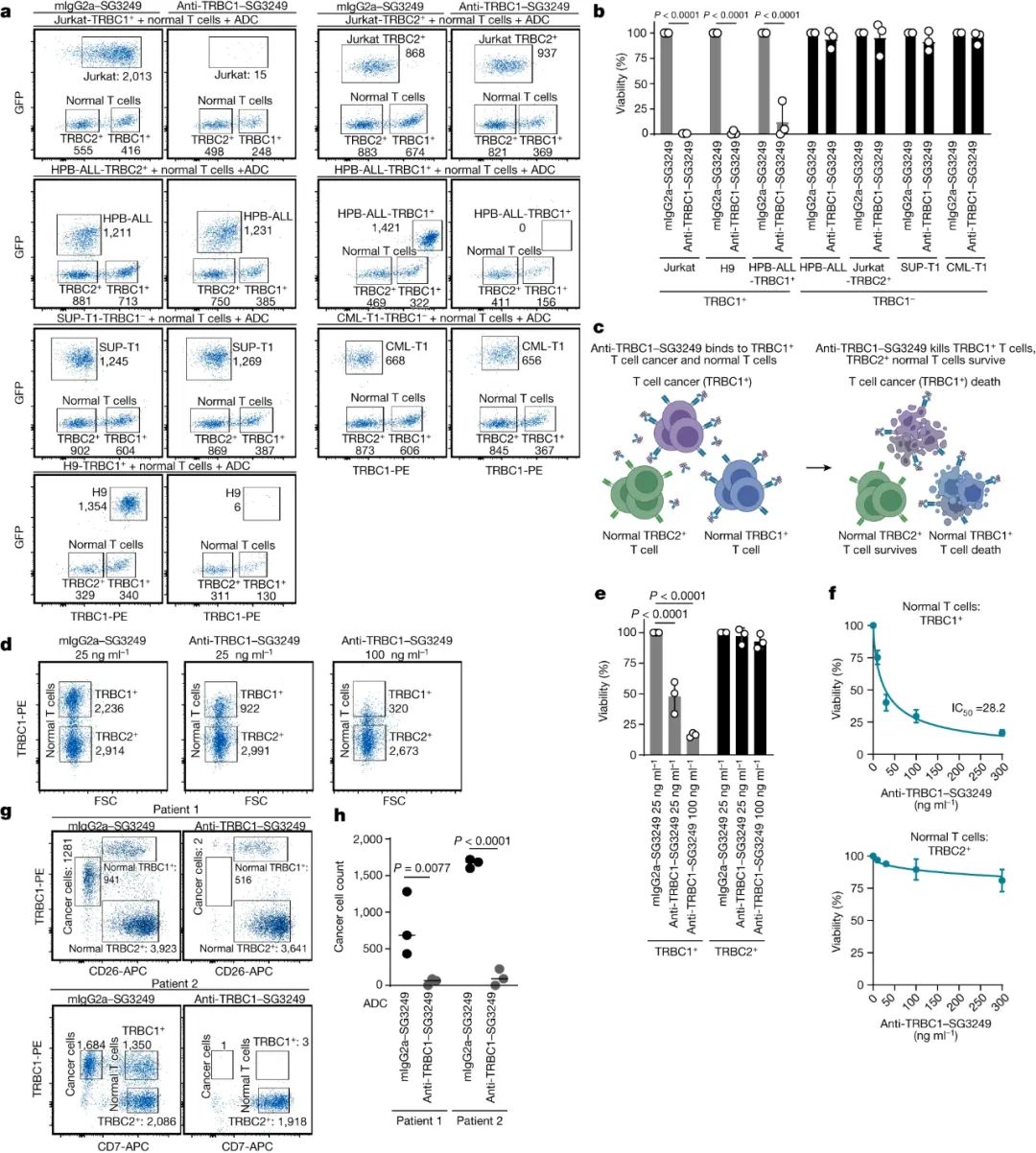
图4. 抗TRBC1-SG3249 ADC在正常T细胞存在下杀死癌细胞
最后,为了评估体内疗效,研究人员在TRBC1 T细胞癌模型中测试了ADC(免疫缺陷小鼠注射Jurkat-TRBC1癌细胞,然后用单剂量ADC治疗)。结果显示,在接受抗TRBC1-MMAE-ADC治疗后,癌症最初消退,但此后复发;经抗TRBC1–SG3249-ADC治疗后,肿瘤未检出,未观察到复发。这说明抗TRBC1-MMAE-ADC延长了小鼠的生存期,抗TRBC1–SG3249-ADC治愈了小鼠。未观察到体重减轻或其他肝脏和皮肤毒性迹象。
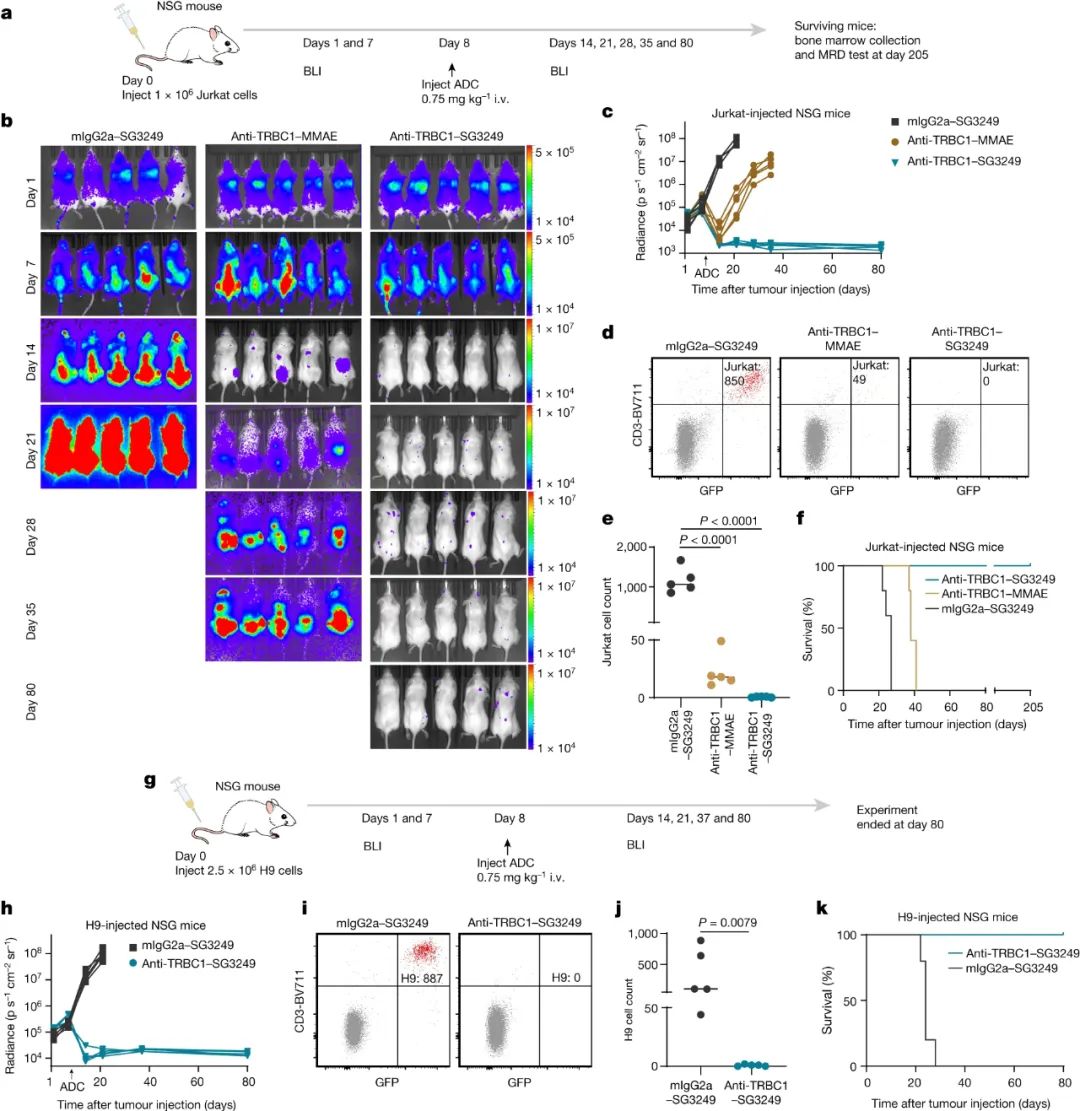
图5. 体内ADC的活性
论文作者表示:“虽然与所有新的治疗药物一样,从临床前到临床应用之间的道路并不平坦、使用SG3249有效载荷时可能有副作用、T细胞癌可能在治疗过程中复发,但抗TRBC1–SG3249-ADC在小鼠模型中治愈了T细胞癌的能力为人体试验奠定了概念和基础。”
参考资料:
Tushar D. Nichakawade, et al. TRBC1-targeting antibody–drug conjugates for the treatment of T cell cancers. Nature(2024)
本篇文章来源于微信公众号: 医药魔方Pro