- A+
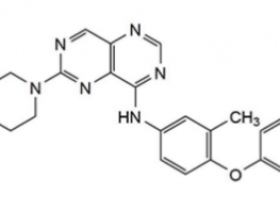
所属分类:EGFR基因突变
注:突破性疗法认定(BTD)指美国食品药品监督管理局(FDA)对新药或新疗法的一种特殊授予,获得BTD的药物通常用于治疗严重或危及生命的疾病,并在早期临床试验中显示出相对于现有疗法更加显著的疗效。该认定旨在加速药物的研发和审批过程,以便更快地使患者受益。

-
其中,在ROS1 G2032R突变型患者中,客观缓解率为78%,即有78%的患者肿瘤大幅缩小或消失;在具有中枢神经系统转移史(具有脑转移)的患者中,客观缓解率为73%,即有73%的患者肿瘤大幅缩小或消失。 -
在先前至少接受过两次ROS1 TKI治疗和至少1次化疗的患者中,客观缓解率为53%,即有53%的患者肿瘤大幅缩小或消失。 -
在先前接受过Lorlatinib或Repotrectinib(两种ROS1 TKI)治疗的患者中,客观缓解率为50%,即有50%的患者肿瘤大幅缩小或消失。
本篇文章来源于微信公众号: 肺解