- A+
癌细胞的生长是由异常的信号传递和代谢重组所驱动的。癌细胞重新规划它们的新陈代谢,以确保在一个缺乏营养和压力小的环境中生长和增殖。代谢变化影响ATP和前体分子产生的分解代谢途径和生物量合成的合成代谢途径。
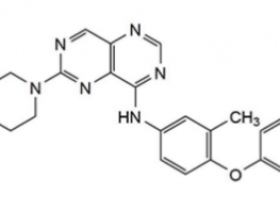
致癌信号和代谢改变在癌细胞中是相互关联的。mTOR在癌症中常被激活,控制细胞的生长和新陈代谢。mTOR信号调节氨基酸、葡萄糖、核苷酸、脂肪酸和脂质代谢。相反,代谢改变,如葡萄糖或氨基酸摄取的增加也会影响mTOR信号传递。文章“mTOR signalling and cellular metabolism are mutual determinants in cancer”讨论了mTOR信号是如何改变癌细胞代谢,以及代谢的变化是如何维持mTOR信号和致瘤性的。以此希望利用mTOR信号和代谢的相互依赖关系更好地治疗癌症。
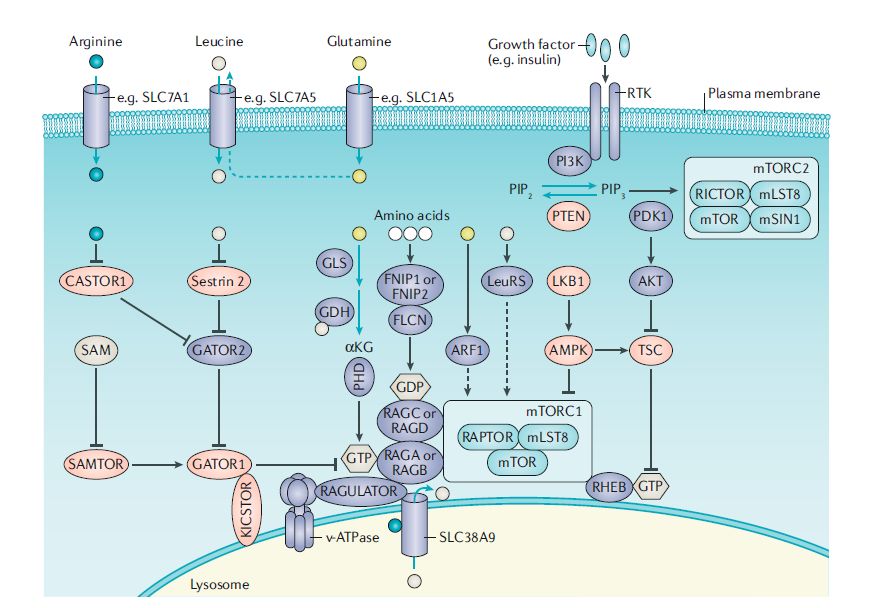
●mTOR和氨基酸代谢
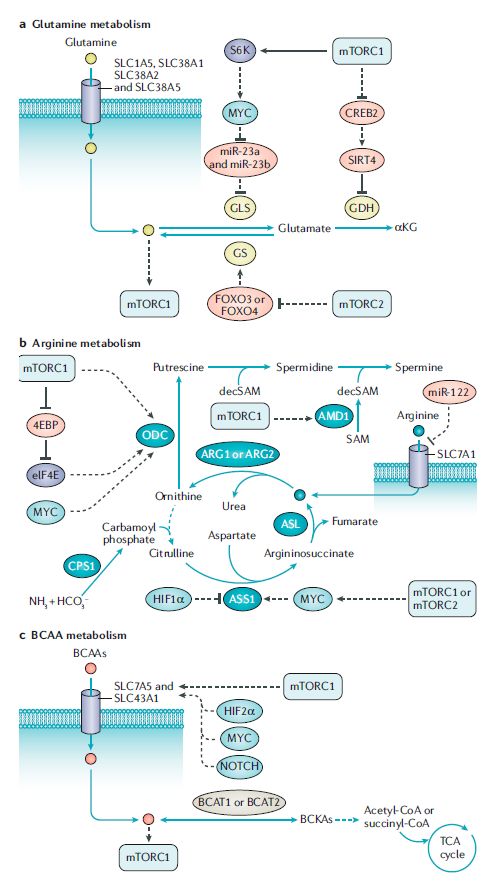
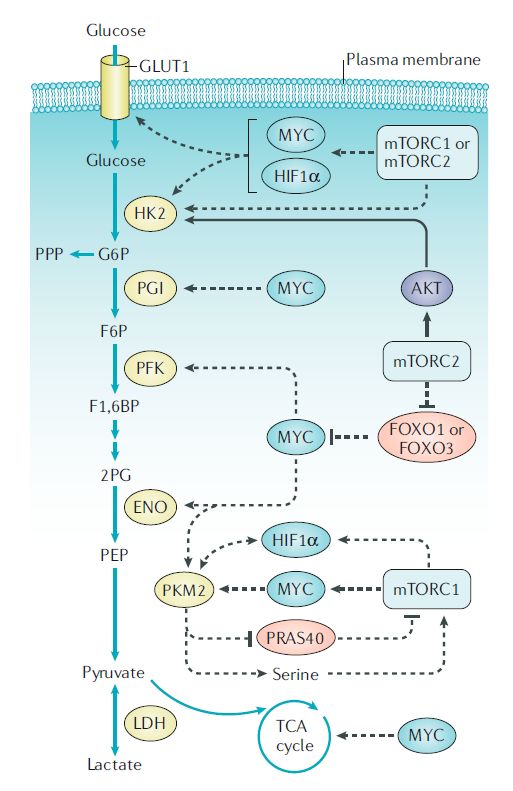
●mTOR信号和葡萄糖代谢
●mTOR和核苷酸代谢
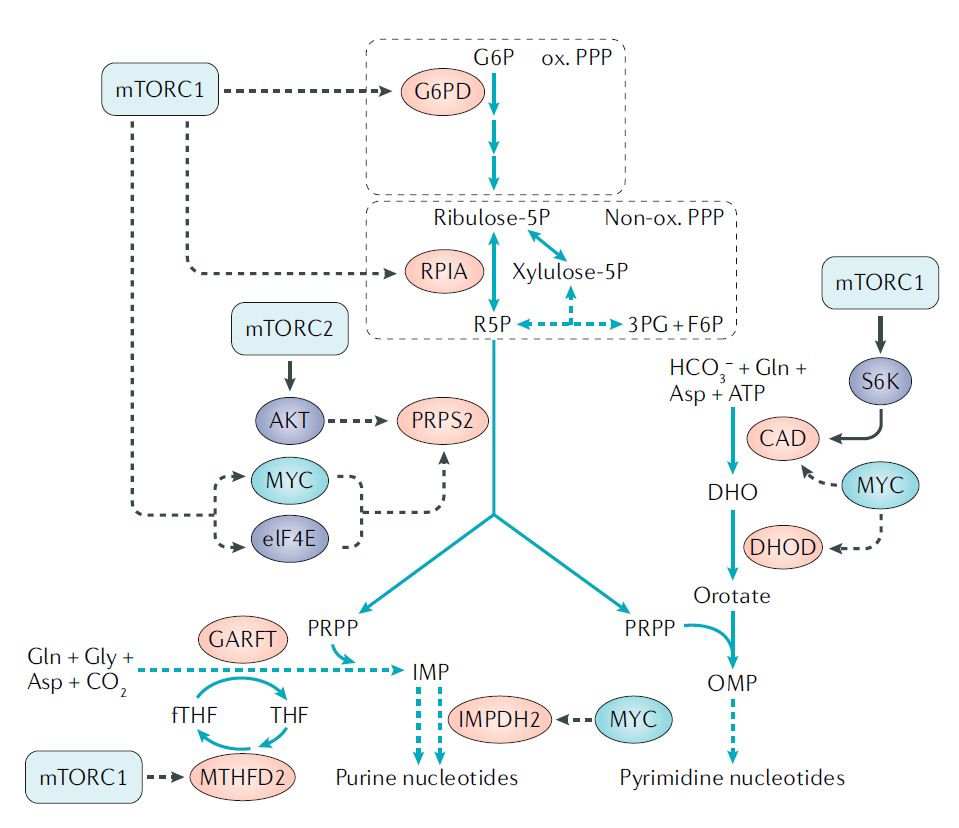 rewiring of nucleotide metabolism by mTOr
rewiring of nucleotide metabolism by mTOr
●mTOR和脂肪酸、脂质代谢
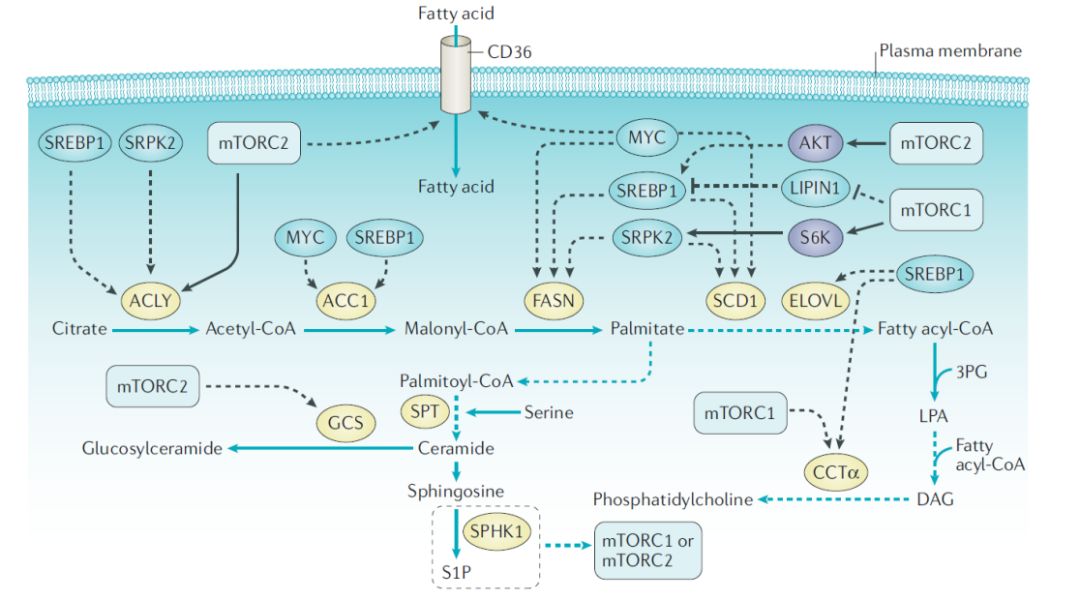

除此之外,一些研究揭示了mTOR信号和氨基酸代谢之间的联系,这些氨基酸没有被认为是mTORC1的激活剂,即谷氨酰胺、精氨酸和亮氨酸以外的氨基酸。例如,mTORC1促进丝氨酸的生物合成,mTORC2调控谷氨酸胱氨酸抗转运蛋白xCT(又称SLC7A11),该蛋白在三阴乳腺癌和GBM中上调,一部分癌细胞依赖脯氨酸摄取维持mTORC1 4EBP信号。除了氨基酸外,其他代谢产物也可以调节mTORC1活性,包括S-腺苷蛋氨酸(SAM)、嘌呤核苷酸和胆固醇。相反,mTOR信号调节核苷酸、脂肪酸和脂质代谢的多个方面。这些发现进一步表明,mTOR抑制剂可用于mTOR相关代谢改变的癌症。
为了实现这一战略,进一步了解代谢重编程和mTOR信号的相互决定论是很重要的。对于驱动突变如何决定肿瘤的发展和代谢改变的观点,提出的一个概念是,癌症细胞如何重新规划其代谢,取决于其起源组织而非潜在突变。因此,有必要对癌症亚型的代谢特征进行分类,以供选择治疗方案。这类分类还可能揭示如何利用代谢弱点进行治疗。例如,在LSCC中,代谢特征被建议用来预测mTOR抑制剂的反应性或耐药性。
一些干扰细胞代谢的药物,如二甲双胍、二氯醋酸盐或二硫胺素,多年来一直用于治疗代谢疾病,现在正被重新用于癌症治疗。例如,治疗2型糖尿病最常用的处方药物二甲双胍,可以激活AMPK,抑制mTORC1,减弱蛋白质合成、TCA循环和核苷酸合成。二甲双胍单独使用或与其他抗癌药物联合使用,已被证明在几个模型中对减少肿瘤生长有效。并且二甲双胍目前正在进行一些包括与mTORC1抑制剂联合使用的临床试验。
一些临床试验正在评估mTOR抑制剂与其他干扰癌细胞代谢的靶向药物的联合使用。然而,我们需要了解靶向代谢的抗癌药物如何影响肿瘤微环境中的癌症和非癌症细胞来优化治疗策略, 如如何避免药物引起的免疫抑制。因此,针对精氨酸或葡萄糖缺乏的治疗策略也会抑制T细胞的活化和增殖,从而可能阻止对肿瘤的足够免疫反应。
第一代mTOR抑制剂和靶向代谢改变的药物作为单一药物治疗效果较差。第二代mTOR抑制剂目前正在测试中,更多干扰代谢改变的药物正在研发中。mTOR信号和代谢重编程之间广泛的相互作用有力地支持了针对代谢的药物与mTOR抑制剂组合的进一步探索。
-参考文献:
Mossmann Dirk,Park Sujin,Hall Michael N,mTOR signalling and cellular metabolism are mutual determinants in cancer.[J] .Nat. Rev. Cancer, 2018, undefined: undefined.