- A+
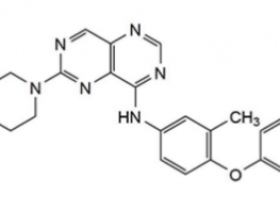
2021年5月28日,美国FDA宣布加速批准安进(Amgen)公司开发的Lumakras(sotorasib,AMG510)上市,用于治疗肿瘤携带KRAS G12C突变的非小细胞肺癌(NSCLC)患者。这些患者至少接受过一种前期全身性治疗。这是全球范围内首款靶向KRAS蛋白的抗肿瘤药物。Lumakras是由安进公司开发的一款“first-in-class”的KRASG12C突变体抑制剂,Lumakras的获批上市距离安进公司提交新药上市申请(NDA),仅仅6个月。
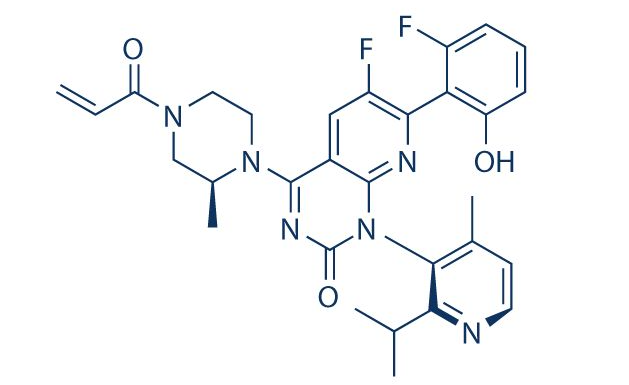
RAS是第一个被发现的人类肿瘤基因(oncogene)。KRAS基因的全名叫Kirsten rats arcomaviral oncogene homolog,翻成中文是“Kirsten大鼠肉瘤病毒癌基因同源物”。KARS基因编码的蛋白是一种小GTP酶(smallGTPase),它属于RAS超蛋白家族。
1. KRAS基因的分类
在人的基因组中,有 2 个 KRAS 基因。一个是 KRAS1,位于第6号染色体的短臂上;另一个是 KRAS2,位于第 12 号染色体的短臂上。其中,KRAS1 是“假基因”,不能被转录成 RNA,所以它是没有功能的。而KRAS2才是“真基因”,能够转录、并且翻译成蛋白,具有生物学活性。通常公司和文献报道中所研究的KRAS基因和蛋白,是指“KRAS2”基因及其蛋白产物。
KRAS基因属于RAS基因家族。RAS基因家族当中,还有NRAS (neuroblastoma-RAS)和HRAS (Harvey-RAS)。
2. KRAS蛋白的结构和位置
KRAS蛋白质有188个氨基酸,它的分子量是21.6KD。拥有GTPase酶活性的鸟嘌呤核苷结合蛋白。
KRAS蛋白定位在细胞膜的内侧,通过一个法呢酰基(Farnesyl)的修饰基团【1】,连到细胞膜上。法呢酰基,是通过翻译后的蛋白修饰,在法呢酰基转移酶【2】的作用下,加到KRAS蛋白上的【3】。
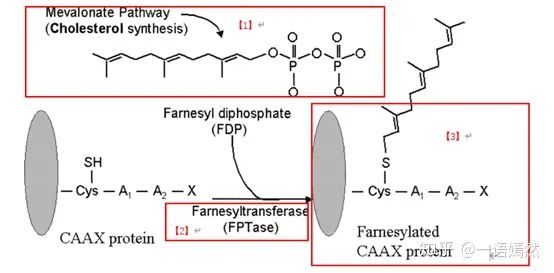
来源:Farnesyltransferaseinhibitorsinhematologicmalignancies:newhorizonsintherapy
3. KRAS相关通路
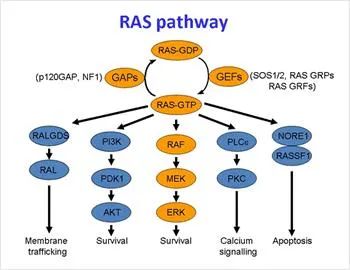
正常细胞中,细胞膜上的EGFR、HER2、ErbB3和ErbB4等受体单体与细胞膜外配体结合形成二聚体,二聚体自身磷酸化,再磷酸化下游的信号蛋白。其中一条信号通路可激活Grb2-Shc,再激活SOS蛋白,进而可激活KRAS蛋白。
KRAS通路
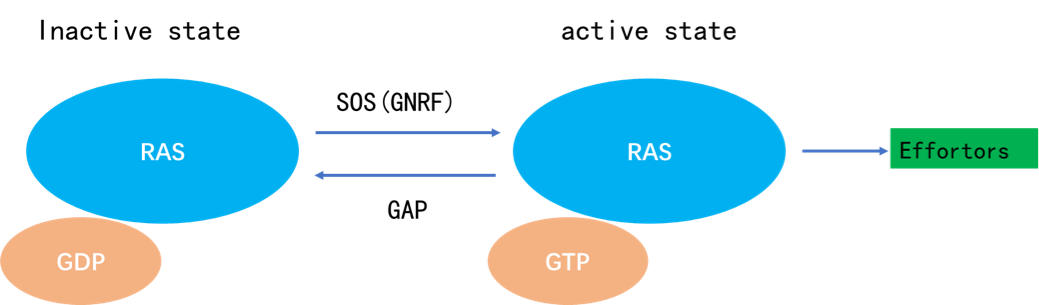
在细胞内,KRAS蛋白在失活和激活状态之间转变,当KRAS与鸟嘌呤核苷二磷酸(GDP)结合时,它处于失活状态,当它与鸟嘌呤核苷三磷酸(GTP)结合时,它处于激活状态,并且可以激活下游信号通路。
下游信号通路
大部分细胞中的KRAS处于失活状态,当它被激活后,可以激活多条下游信号通路,其中包括MAPK信号通路,PI3K信号通路,和Ral-GEFs信号通路。这些信号通路在促进细胞生存、增殖和细胞因子释放方面具有重要作用。
4. KRAS活性的调节因子
KRAS在失活与激活状态之间的转换受到两类因子的调节。
一类是鸟嘌呤核苷酸交换因子(GEF),这类蛋白催化KRAS与GTP的结合,从而促进KRAS的激活,其中包括SOS蛋白(属GEFs/鸟苷释放因子/鸟苷酸交换因子)。
另一类是GTP酶(GTPase)激活蛋白(GAPs),这类蛋白能够促进与KRAS结合的GTP水解成为GDP终止活性状态,从而抑制KRAS的活性。
影响RAS–RAF–MEK–ERK通路组分的突变,包括各种RTK、SHP2、NF1、RAS蛋白、RAF家族成员或MEK1/MEK2,可导致该通路异常激活并致癌。RAS突变或扩增是人类癌症中最常见的突变:KRAS最常发生改变,尤其是在实体肿瘤中;NRAS突变存在于黑色素瘤和许多血液恶性肿瘤中;HRAS突变主要发生在膀胱癌、甲状腺癌、宫颈癌和头颈癌。
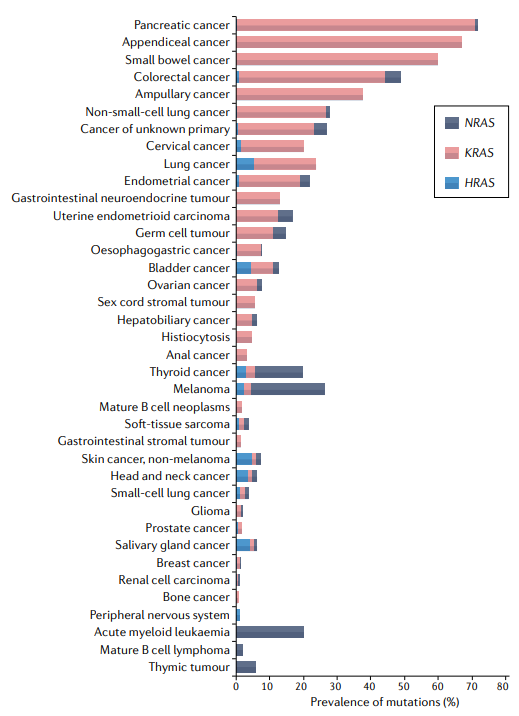
约17%的实体瘤具有KRAS突变,包括约90%的胰腺癌、约50%的结肠癌和约25%的肺腺癌。事实上,KRAS突变在NSCLC中占主导地位,占此类肿瘤中发现的所有RAS突变的约78%。
几乎所有与癌症相关的RAS突变(~95%)都会影响密码子,并导致基础RAS-GTP:RAS-GDP比率显著增加以及RAS效应器的组成性激活。KRAS的甘氨酸残基12(G12)的突变最常见,甘氨酸13(G13)是KRAS第二个最常受影响的残基。KRAS密码子突变最常见的是G12C,G12V或G12D替代,分别占NSCLC中KRAS突变的40%、19%和15%。结构学研究表明,这些基因突变大多干扰KRAS水解GTP的能力。
既然KRAS如此重要,且KRAS基因上的致癌突变十分清楚,那么,为什么到现在为止,仍未上市一个直接针对KRAS基因的靶向药物?原因在于KRAS蛋白是一种无特征、近乎球形的结构,无明显结合位点,很难合成一种能靶向结合并抑制其活性的化合物。长期以来无法攻克,KRAS已成为肿瘤药研发领域"不可成药"靶标的代名词。
困难点在于:
1) KRAS的作用泛围很广,KRAS的正常活性也是许多正常细胞功能所需要的活性,如选取直接抑制KRAS的药物,则该药物毒性可能会很大,副作用也可能会很强。且KRAS与NRAS、HRAS有很高的同源性,能抑制KRAS活性的药物,就很可能会抑制NRAS、HRAS的活性。那么,这个药物的毒性就可能很大。
2) 目前已知的KRAS的活性功能域,主要是KRAS与GDP、或GTP结合的口袋状的功能域。与蛋白激酶与ATP的亲和力较弱不同, KRAS与GTP、或GDP的结合非常强,亲合系数达到PicoMolar(皮摩尔浓度,10^-12)级。而正常细胞里面的GDP与GTP的浓度,达到了MicroMolar(微摩尔浓度,10^-6)级。所以,细胞内正常的GDP与GTP的浓度,比与KRAS结合所需的浓度,高了10的6次方倍。而RAS缺乏足够大的能够结合小分子的口袋;故要做出一种小分子化合物,其与KRAS的结合能力,要能与GDP、或者GTP相匹敌,非常难。
3) 设计一种只针对性抑制突变KRAS蛋白的活性药物,而尽量少影响正常KRAS蛋白的活性,需要此种化合物对突变的KRAS有很好的选择性。这是药物设计的又一个难题。
4) 然而,间接靶向KRAS的策略也是困难重重,包括阻断KRAS细胞膜定位和靶向KRAS下游的信号分子,如RAF、MEK、ERK和PI3K等家族成员。具体而言,间接途径的困难包括:(1)RAS是正常细胞生长和存活相关的必需途径,靶向必需途径首先面临严重的毒副作用,导致疗效指数非常狭窄甚至没有;(2)补偿逃逸机制,以及(3)由于严格调节导致的信号反馈和冗余。
近年来,针对KRAS突变体的共价抑制剂研究的突破让通过异构位点(allosteric)靶向KRAS突变体成为可能。在KRASG12C突变体中,与突变生成的胱氨酸共价结合的小分子更倾向与和GDP结合的KRAS蛋白相结合。而这一结合降低GTP与KRAS的亲和力,同时阻碍GEF催化GTP替换GDP,将KRASG12C突变体锁死在失活状态。KRASG12C突变体上这一结合“口袋“的发现催生了多款靶向KRASG12C突变体的小分子共价抑制剂。
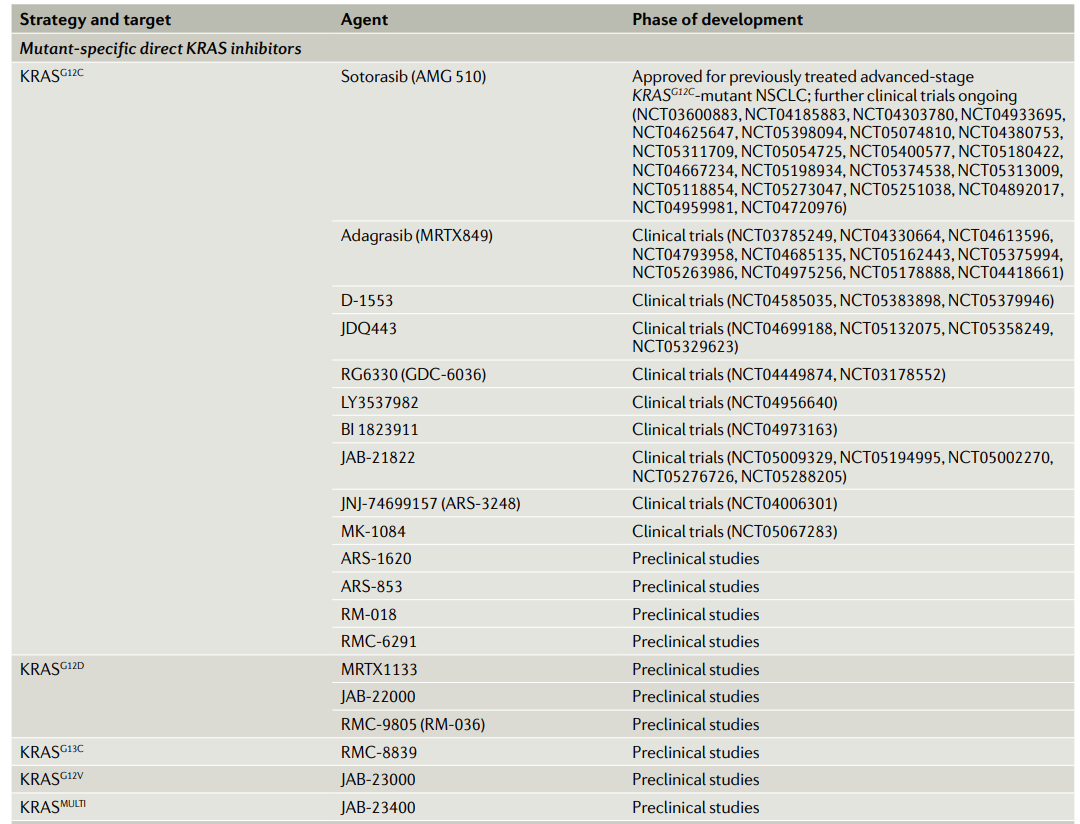
在I/II期的CodeBreaK 100研究中,接受Sotorasib治疗的22名晚期KRASG12C突变型实体瘤患者的首次人类数据表明,在6名NSCLC患者中有一例部分响应(PR)。随后来自本试验I期部分129名患者的数据显示,客观应答率(ORR)为32.2%,59例晚期非小细胞肺癌患者的疾病控制率(DCR)为88.1%,PFS中位数为6.3个月,42例CRC患者的ORR为7.1%,DCR为73.8%,PFS的中位数为4.0个月。黑色素瘤、胰腺癌、子宫内膜癌患者也出现响应应。这些令人印象深刻的结果导致2021 FDA加速批准Sotorasib用于NSCLC。
Adagrasib是第二个进入临床试验的KRASG12C抑制剂,根据I/II期KRYSTAL-1试验的数据,FDA授予其对晚期KRASG12 C突变非小细胞肺癌的突破性疗法认定。该试验的数据于2021在欧洲医学肿瘤学会(ESMO)上发表,结果显示:DCR达到96%,在51名可评估患者中有23例(45%)PR,另有26例SD。此外,在KRYSTAL-1的II期更新数据中,116例既往接受过治疗的NSCLC患者adagrasib治疗后的ORR为42.9%,DCR为79.5%,DoR中位数为8.5个月,PFS中位数为6.5个月,OS中位数为12.6个月,1年OS率为50.8%。Sotorasib对其它适应症的大量试验正在进行中。
此外,其他几种KRASG12C抑制剂也已进入临床开发阶段。GDC-6036(RG6330)在涉及各种晚期KRASG12C突变实体肿瘤(NCT04449874)患者的I期试验正在进行中。JDQ443是另一种共价不可逆KRASG12C抑制剂,一项I/II期试验正在评估JDQ443作为单一疗法,或与TNO155(另一种SHP2抑制剂)和/或tislelizumab(抗PD-1抗体)联合治疗KRASG12C突变型NSCLC、CRC或其他晚期实体瘤患者(KontRASt-01;NCT04699188)。
LY3537982是一种选择性KRASG12C抑制剂,也处于KRASG12C突变实体瘤的I期临床开发中(NCT04956640)。I/II期试验中的其他KRASG12C靶向化合物包括D-1553、JNJ-74699157、BI 1823911、JAB-21822和MK-1084。
虽然KRAS不再是不可成药的,但KRAS抑制剂单药疗效还远远不够。事实上,可塑性和遗传不稳定性使肿瘤对所有单药靶向治疗产生耐药性,KRAS靶向治疗也不例外。
原发耐药性
从理论上讲,对KRAS抑制剂的主要耐药性可能来自肿瘤中的突变异质性或特异性共突变的存在。了解这些耐药机制对于制定治疗策略至关重要。CRC患者不同疾病部位之间的KRAS突变异质性已有描述,可能至少部分解释了此类患者对EGFR靶向治疗的可变反应。
Zhao等人评估了8750例治疗前KRAS突变体肿瘤标本,仅在304例样本中发现了一种以上的RAS突变(3.5%);在KRASG12C突变肿瘤中,发现3%存在继发性RAS突变。目前,对KRASG12C抑制剂原发耐药机制的了解仍然极其有限,需要进行大规模队列多组学分析,以确定与这些药物无反应相关的治疗前因素。
突变逃逸引起的获得性耐药
突变逃逸是指在治疗时产生的耐药性突变,在治疗前无法检测到。常用KRAS抑制剂sotorasib和adagrasib的结合位点由KRASG12C的12、68、95和96位的氨基酸残基形成;因此,影响这些残基的突变与耐药性特别相关。
例如,KRASG12C中获得的第二位点Y96D突变通过改变开关口袋,使抑制剂不再结合,赋予adagrasib临床耐药性。Koga等人在体外实验用sotorasib或adagrasib处理KRASG12C突变Ba/F3细胞后鉴定出了12种不同的次级KRAS突变。
适应性耐药
适应性耐药是指RAS–MAPK通路在某种水平上的快速再激活,通常是由于MYC靶基因的去表达,抑制ERK活性。一些研究表明,在KRASG12C抑制剂处理时会发生类似的途径再激活。事实上,适应性耐药是由突变KRAS的重新激活还是剩余野生型KRAS、HRAS和/或NRAS的激活介导的,目前尚不清楚。
EMT
上皮间质转化(EMT)是对KRASG12C抑制剂固有和获得性耐药的另一种潜在机制。EMT期间,细胞下调上皮基因表达,上调间充质基因表达,从而增加迁移率和侵袭性。Adachi等人使用基因集富集分析来证明EMT是对sotorasib产生内在和获得性耐药的机制。发现在EMT诱导的KRASG12C突变细胞系中,PI3K通路通过旁路IGFR–IRS1信号通路被激活,sotorasib与PI3K抑制剂GDC-0941结合可阻断AKT活化并抑制细胞增殖。这些临床前观察和组合策略值得进一步临床研究。
目前正在探索几种限制适应性耐药性和延长对KRASG12C抑制剂反应的策略。适应性抗性通常涉及几种RTK和RTK配体的上调,在NSCLC和CRC中,KRASG12C抑制导致激活的上游EGFR和/或其他ERBB家族成员的积累,这可能导致从KRASG12C抑制剂单一疗法中逃逸。因此,目前多个临床试验正在研究KRASG1C和EGFR联合抑制。
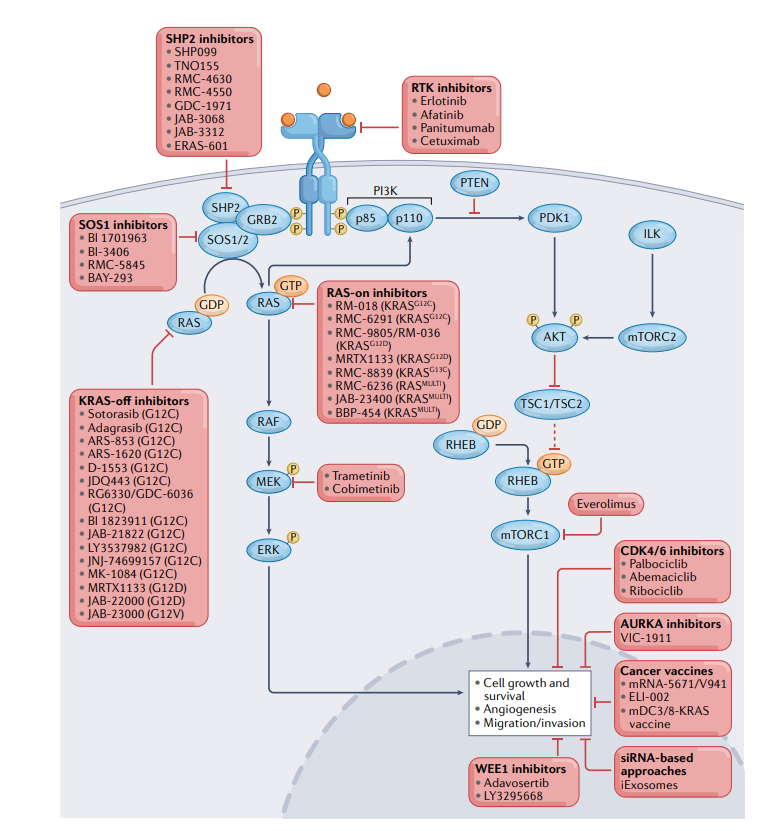
在CodeBreaK 101临床试验中(NCT04185883)中,sotorasib与EGFR/HER2酪氨酸激酶抑制剂afatinib或抗EGFR单克隆抗体panitumumab联合。初步结果显示了可控的安全性,最常见的治疗相关不良反应(TRAE)是腹泻和恶心。在两个剂量队列中,观察到有效性信号,ORR分别为20.0%和34.8%,DCR分别为70.0%与73.9%。此外,adagrasib与另一种抗EGFR单克隆抗体cetuximab在KRYSTAL-1和KRYSTAL-10中联合测试(NCT03785249和NCT04793958)。GDC-6036也正在与cetuximab以及EGFR酪氨酸激酶抑制剂erlotinib联合测试(NCT04449874)。
自1992年发现以来,SHP2已成为RAS–MAPK通路的关键“阳性”上游调节器,因此是多种致癌驱动激酶信号传导的重要组成部分。SHP2在KRAS突变NSCLC的几种模型中是肿瘤发生所必需的,表明SHP2抑制可能在KRAS突变癌症的治疗中起作用。基于临床前研究中SHP2和KRAS联合抑制的有效性提高,目前正在KRYSTAL-2试验(NCT04330664)中测试SHP2抑制剂TNO155与adagrasib的联合应用。此外,其他几个临床试验正在评估各种SHP2抑制剂和KRASG12C抑制剂的组合。
除了RAS信号通路垂直方向上的联合抑制,在水平方向,人们已开始测试不同的组合策略。例如,抑制mTOR作为克服对KRAS抑制剂的适应性抗性的替代策略。在CodeBreak 101临床试验中,mTOR抑制剂everolimus正在与sotorasib联合评估(NCT04185883)。
细胞周期抑制提供了另一种与KRAS抑制剂协同作用的潜在水平组合策略。此外,包括Aurora激酶(AURKA、AURKB和AURKC)抑制剂、有丝分裂检查点激酶WEE1抑制剂都在临床前试验中和KRASG12C抑制剂联合进行测试。
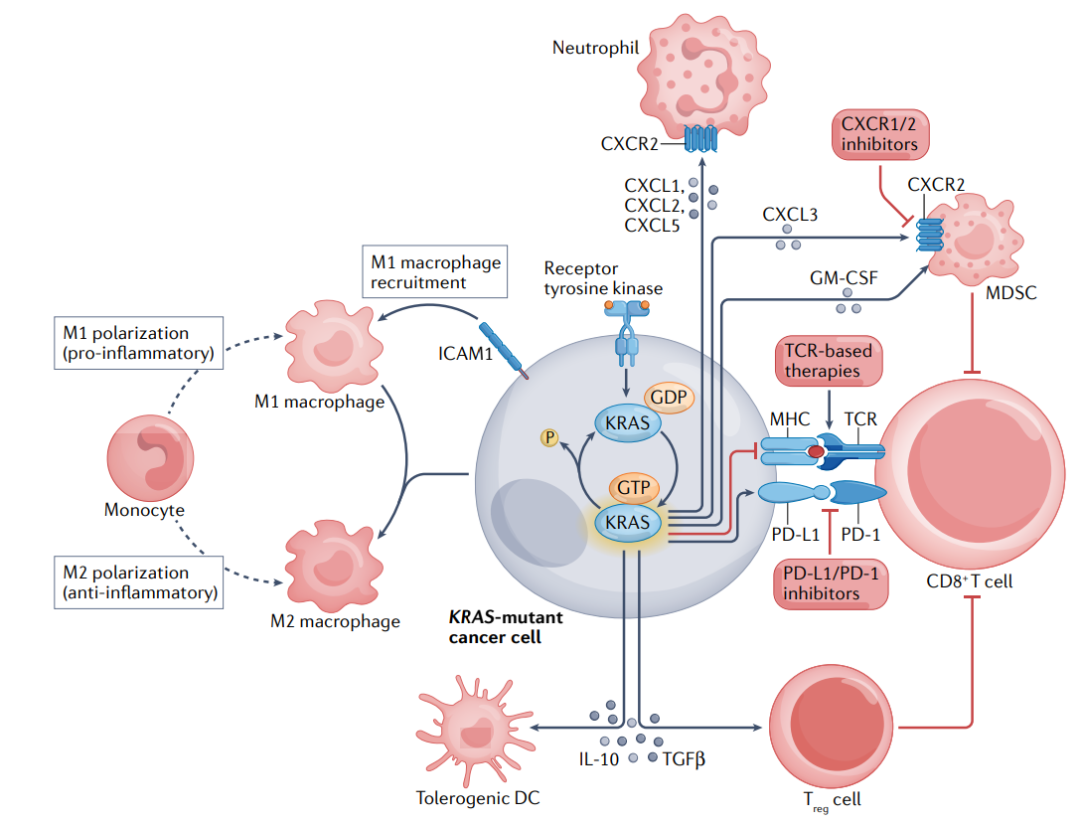
此外,KRAS具有多种免疫调节作用,通过多种机制介导。KRAS的活化增加了中性粒细胞趋化因子CXCL1、CXCL2和CXCL5的产生;通过上调细胞间粘附分子1(ICAM1)表达促进促炎性M1巨噬细胞的募集;通过分泌TGF-β和IL-10诱导免疫抑制调节性T(Treg)细胞分化。
基于这些发现,将KRAS抑制剂与ICIs结合是一种合理的策略。目前,将KRASG12C抑制剂与ICI结合的方法正在KRASG12C突变实体肿瘤的多个临床试验中进行评估(NCT03600883、NCT04185883、NCT03785249、NCT04613596、NCT04449874和NCT04699188)。
靶向KRAS其它亚型
鉴于KRASG12D的内在GTP酶活性低于KRASG12C,大多数KRASG12D蛋白将与GTP结合。因此,靶向KRASG12D-GTP以及其他RAS亚型一直是药物开发的焦点。
2020年,Zhang等人鉴定了三种独特的环肽配体,它们优先结合在KRASG12D-GTP的开关2凹槽内,并抑制其与RAF蛋白的相互作用。值得注意的是,这些化合物对野生型KRAS没有明显的影响,这体现了KRAS突变体GTP结合态的不同特征。
另一种新的靶向突变KRAS和/或其他突变RAS亚型的策略,使用了类似于免疫抑制剂环孢菌素、FK506和雷帕霉素的机制。已经开发了与亲环蛋白A结合并随后与各种RAS蛋白形成抑制性三聚体复合物的各种化合物。最近,关于新一代“三聚体复合物”KRAS-on抑制剂RMC-6291的临床前数据,表明其优于KRAS-off抑制剂adagrasib,支持了这种靶向方法的可行性。
靶向RAS降解
RAS降解是靶向RAS突变恶性肿瘤的另一种新方法。蛋白质水解靶向嵌合体(PROTACs)通过结合目标蛋白和E3泛素连接酶促进疾病相关蛋白的蛋白酶体降解。LC-2是针对KRASG12C设计的PROTAC,类似设计的pan-KRAS和其他突变特异性KRAS降解剂正在临床前开发中。
使用嵌合毒素是RAS靶向的另一种替代方法。RRSP–DTB是一种此类毒素,由源自创伤弧菌的RAS/RAP1特异性内肽酶(RRSP)和白喉毒素(DTB)的易位B片段组成。该毒素通过肝素结合EGF样生长因子(HB-EGF)介导的内吞作用进入细胞,随后在开关1区切割RAS。
靶向KRAS的免疫疗法
2016年,Tran等人首次描述了针对KRAS突变癌细胞的内源性免疫应答,他们鉴定了CD8+TIL与识别MHC I(HLA-C*08:02)呈递的肽新表位的T细胞受体(TCR),这些新表位来源于KRASG12D。使用这些特异性TIL的ACT使分离出KRASG12D突变CRC的患者的所有七个肺转移消退。靶向KRASG12V突变体细胞的TCR-T细胞已进入临床试验。
治疗性癌症疫苗构成了靶向KRAS突变肿瘤的另一种基于免疫的方法。已经开发了一种以KRAS的G12D、G12V、G13D和G12C变体为靶点的mRNA新抗原疫苗mRNA-5671/V941。mRNA-5671/V941已进入I期临床试验。此外,目前正在一项I期试验(NCT04117087)中联合ICIs评估具有抗KRAS G12C、G12V、G12D、G12A、G13D和G12R变体活性的长肽疫苗。
基于siRNA的方法
人们已经开发了基于纳米颗粒的平台,以递送KRAS特异性小干扰RNA(siRNA)。该技术已被证明可充分输送至癌细胞,并有效降低其KRAS水平,从而产生抗癌活性。临床前研究表明,基于siRNA的方法对抗KRAS驱动的癌症可能是可行的治疗策略。
自三十多年前在肺癌中发现KRAS突变以来,KRAS靶向药物的发现已经取得了很大进展,目前有大量抑制剂、联合方法和新的替代靶向方法正在临床研究中。然而,关于KRASG12C抑制剂的数据表明,这些药物远未达到治愈效果。至少部分原因在于单药治疗几乎总是产生耐药性。
目前,人们正试图通过垂直抑制RAS通路的多个节点来克服耐药性机制。此外,治疗策略还包抑制平行通路的组合策略,联合免疫治疗策略诱导持久的抗肿瘤记忆免疫反应。最后,人们也在不断开发新方法以及新的治疗策略来靶向RAS,我们期待着这些新的方法能够在KRAS突变恶性肿瘤患者群体中实现长期寻求的治愈目标。
参考文献:
1. The current state of the art and future trends in RAS-targeted cancer therapies. Nat Rev Clin Oncol.2022 Aug 26 : 1–19.
本篇文章来源于微信公众号: 小药说药