- A+

激酶是控制细胞功能的关键酶。在人类基因组中有518种激酶编码基因,这些酶可以磷酸化多达三分之一的蛋白质组。在肿瘤细胞中的激酶常常过度活跃,使相应的调节机制难以正常发挥作用,因而异常的细胞不受控制地增殖,肿瘤组织就会启动血管的形成以维持自身的生存。而激酶抑制剂可以有效延缓某些肿瘤中的肿瘤生长速度。
在过去的30年里,人们将激酶作为药物靶向目标进行了深入的研究,并取得了很大的成效。统计至去年年底,已有38种激酶抑制剂药物获批上市。其中以受体酪氨酸激酶(RTK)抑制剂居多,自2001年FDA批准用于慢性粒细胞白血病治疗的酪氨酸激酶抑制剂伊马替尼上市,由于其良好的选择性和相对较弱的副作用,开启了激酶抑制剂的研究热潮。
2001-2017年获批上市的激酶抑制剂

发表于《Nature Review Drug Discovery》的文章“Kinase inhibitors: the road ahead”详尽深刻地总结了针对激酶靶向小分子正在开发的新靶点、生物学过程和疾病领域,以及相应的挑战和优化激酶抑制剂的策略技术。

虽然激酶抑制剂的研发思路越来越清晰,但在药物的实际研发过程中仍存在不小的挑战,阻碍了激酶在肿瘤学和其他领域作为药物靶点的开发潜力。这些挑战包括新的激酶靶点的验证、在非肿瘤性治疗领域使用激酶抑制剂、克服耐药性、靶点选择性提高以减少非靶点介导的毒性以及开发高效的化合物筛选和分析技术。

激酶抑制剂的研究在肿瘤学领域迅速扩展,并扩展到不同的疾病领域,包括自身免疫和炎症疾病以及退行性疾病。
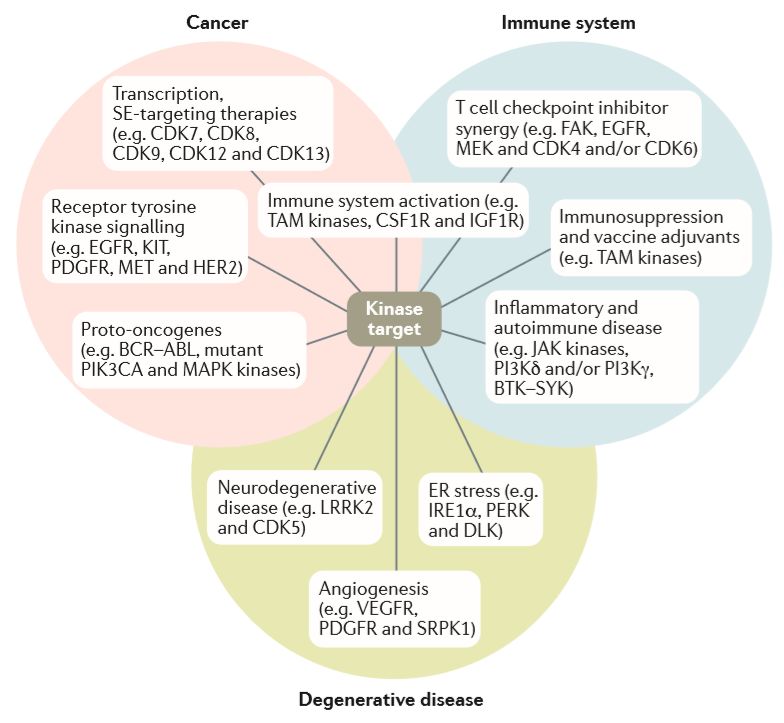
图:不同的生物过程和新的治疗领域的激酶抑制剂
激酶的靶向目标
1.肿瘤

- 原肿瘤基因,如BCR-ABL、PIK3CA和MAPK激酶驱动肿瘤中的异常增殖。针对这个家族已批准的抗肿瘤药物,如伊马替尼等。
- 受体酪氨酸激酶,如EGFR和VEGFR等,可以促进肿瘤细胞增殖和血管生成。针对这类激酶获批的抗肿瘤药物如厄洛替尼等。
- 转录相关激酶,如CDK7和CDK9,在调控转录中起着关键作用。最近,这些激酶已成为潜在的肿瘤药物靶点,最新的针对转录激酶的抑制剂正在第I/II期临床试验中。
- 免疫系统相关激酶,如TAM激酶(TYRO3, AXL和MER),在免疫系统调节中起着关键作用。因此,抑制这些激酶可能对肿瘤和缓解免疫抑制(例如,在感染性休克的后期)或作为疫苗佐剂都十分有益。

- T细胞检查点抑制剂在少数肿瘤患者中实现了完整和持续的响应。作为致肿瘤激酶,如EGFR和CDK4和/或CDK6,可以帮助免疫系统逃避肿瘤侵袭,鉴定与T细胞检查点抑制剂治疗协同作用的激酶抑制剂并使耐药性肿瘤对其作用敏感。
- 自身免疫和炎症性疾病的治疗,如类风湿性关节炎,其中JAK抑制剂最近获得批准。

- 过度的内质网应激导致退行性疾病,如视网膜色素变性和糖尿病。
- 抑制未折叠蛋白反应途径中的激酶,如IRE1α,是这些罕见病的希望靶点。
- 驱动血管生成的激酶是眼部退行性疾病中高度相关的靶点,如湿性年龄相关性黄斑变性。
- 在神经退行性疾病中有许多有希望但尚未被充分研究的激酶靶点,如LRRK2和CDK5。
挑战
- 尽管激酶抑制剂的研究在肿瘤学领域迅速扩展,并扩展到不同的疾病领域,但仍然面临严峻的挑战。
- 耐药性的出现是促进肿瘤缓解的一大重要障碍。开发耐药突变特异性抑制剂可以延长患者的生存时间,但必然会发生新的耐药。诸如第三代EGFR-T790M抑制剂osimertinib由于EGFR-C797S突变而失去作用。
- 其他的抗性机制,如激酶上调、补偿机制和旁路效应都是很难攻克的问题,这也使人们不得不寻找更不易产生抗性的治疗方法。
- 获得药理学靶点验证所需的选择性仍然是早期激酶抑制剂项目中最大的障碍之一。然而,这对于理解目标生物学和减轻脱靶毒性至关重要。对于更高级的化合物,实现所需的药效学性质,特别是药物停留时间,对疗效至关重要。
展望
- 激酶作为肿瘤学的药物靶点已有30多年的历史。通过我们的努力改变了肿瘤治疗方法,也提供了更多有价值的治疗方案,并且临床上也正在向其他疾病领域扩展。
- 激酶抑制剂药物在激酶导向药物化学中的创新策略继续推动着激酶抑制剂药物向新的靶标空间的扩展。诸如激酶降解物的开发等,有助于新的药理学的发现,同时也推动已知激酶靶点的研究。将最近开发的新型共价弹头转化为激酶抑制剂也为未来研究创造了无限可能,如果成功,可以拓宽共价激酶药物的适用范围,增加治疗领域。
- 激酶指导的药物化学从根本上依赖于选择性筛选。这一领域的关键发展包括确定细胞靶点的平台和提供蛋白质组选择性数据的平台。计算数据库挖掘策略和生化分析为优化化合物研究提供了有效的途径。为了评估它们对激酶抑制剂排序的准确性和可靠性,虽然仍需要对新的计算对接和评分方法进行验证,但也已初见成效。

- 参考文献
[1].Ferguson F M, Gray N S. Kinase inhibitors: the road ahead.[J]. Nature Reviews Drug Discovery, 2018.
[2].Wu P, Nielsen T E, Clausen M H. Small-molecule kinase inhibitors: an analysis of FDA-approved drugs[J]. Drug Discovery Today, 2016, 21(1):5-10.
[3].https://www.fda.gov/Drugs/DevelopmentApprovalProcess/DrugInnovation/ucm537040.htm
[4].Cohen P. The regulation of protein function by multisite phosphorylation--a 25 year update.[J]. Trends in Biochemical Sciences, 2000, 25(12):596-601.