- A+
大多数药物通过与靶蛋白的特定位点结合来阻断或调节靶蛋白的功能。然而,许多蛋白质的活性不能以这种方式改变。以蛋白水解靶向嵌合体(Proteolis -Targeting Chimaeras,PROTACs)为代表的蛋白降解剂能够以非传统的方式改变蛋白质的功能。这种新型药物分子可促进靶蛋白的泛素化标记,然后,被标记的靶蛋白会被细胞的蛋白酶体机制降解为小的肽分子。但是,由于泛素介导的降解途径发生在细胞内,因此蛋白降解剂目前主要攻击细胞内的靶点。

7月29日,最新发表在Nature杂志上的一项研究中,来自斯坦福大学的科学家团队报道了一种不同的蛋白降解技术——溶酶体靶向嵌合体(lysosome-targeting chimaeras, LYTACs),为靶向降解细胞外以及膜结合蛋白开辟了新的可能。
研究人员报告称,溶酶体靶向嵌合体(LYTACs)是一种双功能分子,有两个结合域(下图),一端携带与细胞表面跨膜受体CI-M6PR(cation-independent mannose-6-phosphate receptor)结合的低聚糖肽(oligoglycopeptide)基团,另一端携带一个与靶蛋白结合的抗体或小分子。这两个结合域通过一个化学linker连接起来。
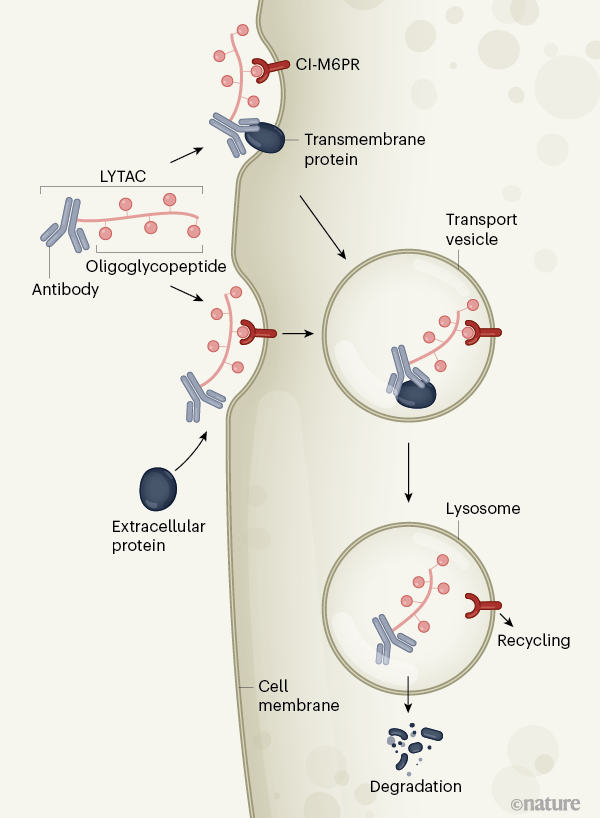
在质膜上形成的三聚CI-M6PR–LYTAC–靶蛋白复合物会被细胞膜“吞没”,形成一个运输囊泡。囊泡会将复合物运输到溶酶体中(一种含有蛋白质降解酶的细胞器),之后靶蛋白被降解。
具体来说,在这项新研究中,Steven M.Banik等科学家首先设计了不同大小和含有不同linker的LYTACs,并用一种名为生物素的小分子作为靶蛋白结合域。研究人员观察到,这些LYTACs能够以需要与CI-M6PR结合的方式,快速地将细胞外的荧光抗生物素蛋白运送到细胞内溶酶体中。当他们用一种能够识别载脂蛋白E4(一种与神经退行性疾病有关的蛋白)的抗体取代生物素时,该蛋白也被内化并被溶酶体降解。
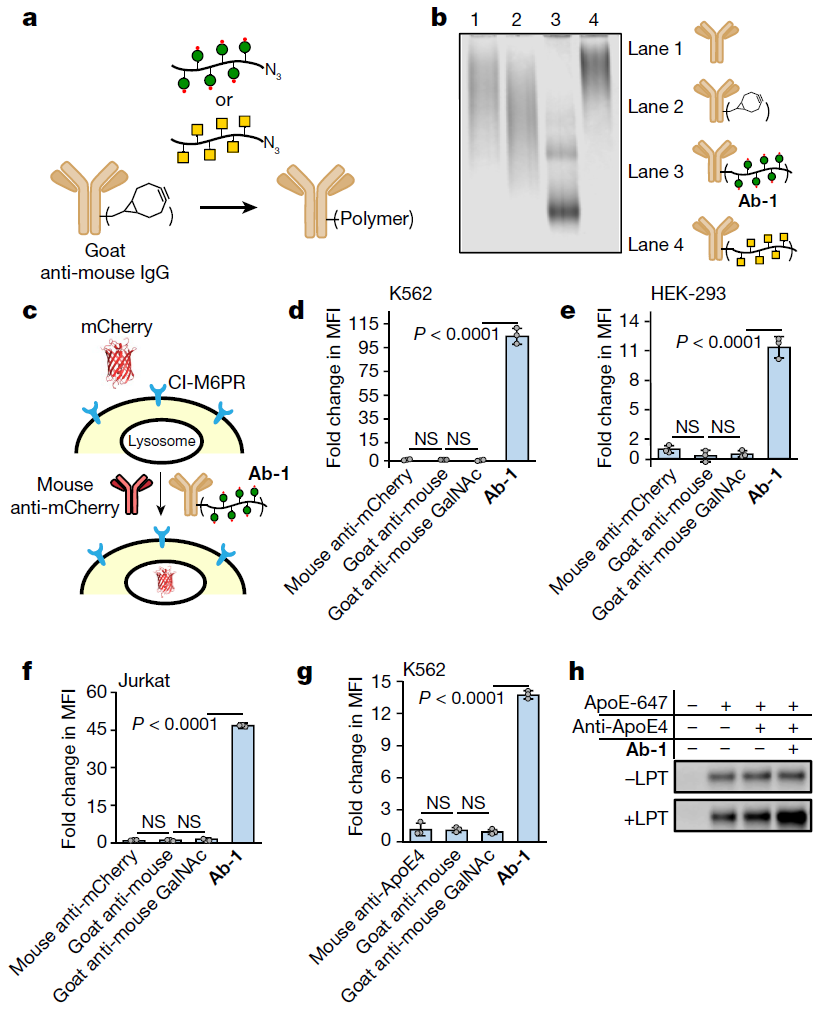
接下来,Banik等人研究了LYTACs是否能够诱导作为药物靶点的膜蛋白降解。结果显示,在多个癌细胞系中,LYTACs确实诱导了表皮生长因子受体(EGFR,一种通过激活信号通路驱动细胞增殖的膜蛋白)的内化和溶酶体降解。与使用抗体阻断EGFR相比,在这些癌细胞系中利用LYTACs降低EGFR水平降低了EGFR下游的信号激活。这一结果证实了先前报道的在治疗应用中使用“靶降解”(target degradation)的优势。
使用LYTACs靶向其它单次跨膜蛋白也观察到了类似的结果,包括靶向降解帮助癌细胞逃避免疫系统攻击的PD-L1。
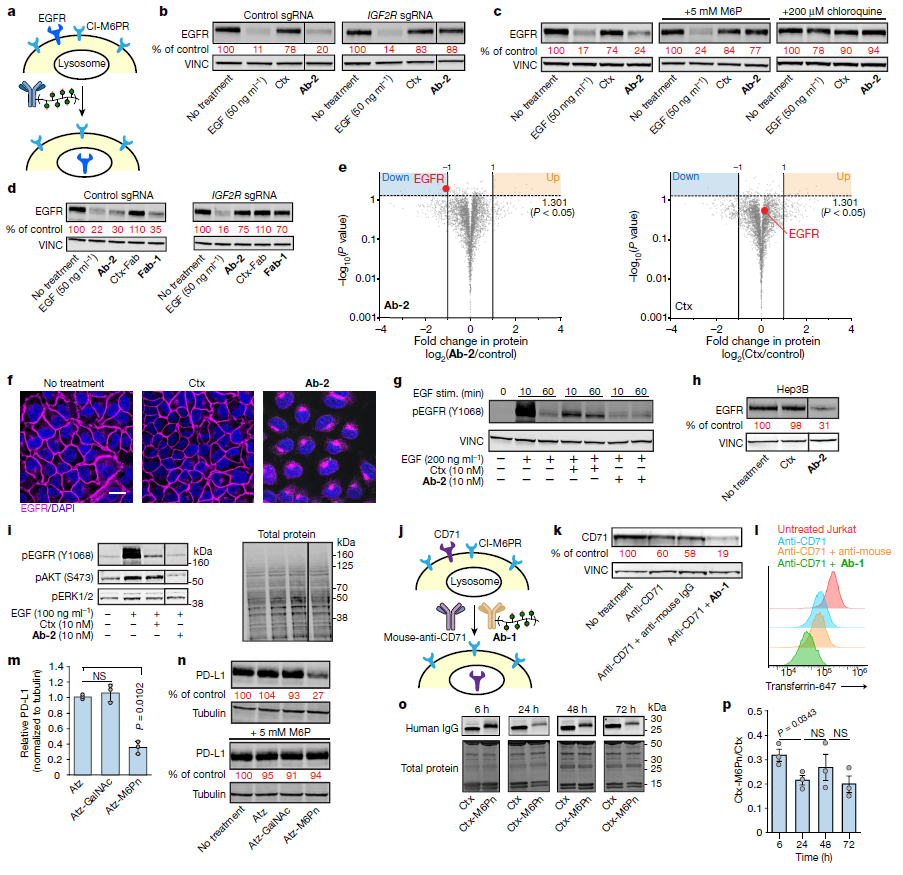
据研究人员透露,下一步,他们想要了解,LYTACs是否也能诱导多次跨膜蛋白(包括普遍存在的G蛋白偶联受体)和跨膜运输物质的蛋白(如离子通道和溶液载体蛋白)的降解。
Nature杂志针对这项新研究进展配发的评论文章指出,如果LYTACs可降解这些蛋白,那么,比较这种新技术与PROTACs的性能将是很有趣的。因为,LYTACs可以结合这些蛋白质的胞外结构域,而PROTACs可以结合这些蛋白质的胞内结构域。
此外,该文章也提到,与任何新的药物模式一样,LYTACs还有很多可以改进的地方。例如,Banik和同事的第一个靶向PD-L1的LYTACs只导致了该蛋白的部分降解,而他们将这一结果归因于所用细胞系中CI-M6PR的低表达。考虑到这种情况,设计LYTACs也可以用其他溶酶体靶向受体(Lysosome-shuttling receptors)来替代CI-M6PR。
靶向蛋白降解是一种很有前途的治疗策略,首个PROTACs药物目前正在临床试验中接受评估。从应用方面来讲,LYTACs与PROTACs互为补充。PROTACs是主要靶向细胞内蛋白的一种双功能蛋白降解剂,通过一个linker连接“靶蛋白的配体”以及“E3泛素连接酶的招募配体”,也就是说,PROTACs一端与靶蛋白结合,另一端与E3泛素连接酶结合。而E3泛素连接酶可通过将泛素“贴”在靶蛋白上将其标记为缺陷或受损蛋白。之后,细胞的蛋白粉碎机(即26S蛋白酶体)会识别和降解被标记的靶蛋白。
受分子大小的影响(比传统药物大),PROTACs通常不能很好地渗透到生物膜中,但对于LYTACs来说,分子大小应该不是什么大问题,因为它们不需要穿过细胞膜。
总体来说,LYTACs作为能够扩大可降解蛋白质范围的有效工具,前景非常令人期待。当然,如果要开发成一种用于人体的新疗法,需要进一步揭示LYTACs的药代动力学、毒性,以及它们是如何代谢、分布和排泄的。
随着PROTACs、LYTACs等技术不断发展、成熟,以及新的蛋白降解技术的出现,也许有一天,没有一个蛋白是无法靶向降解的?随之而来的,可能是多种疾病治疗领域的里程碑进展。