- A+
所属分类:新药资讯
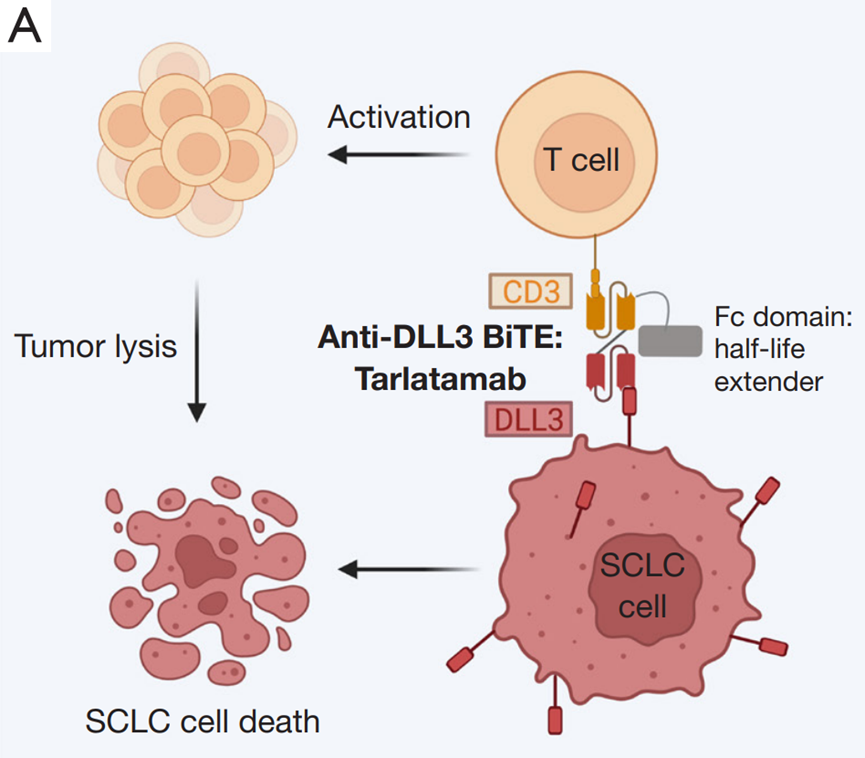
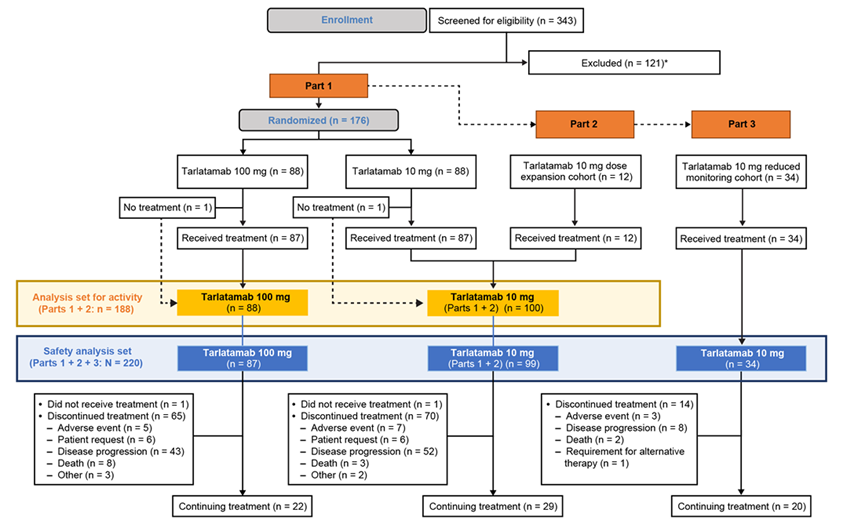
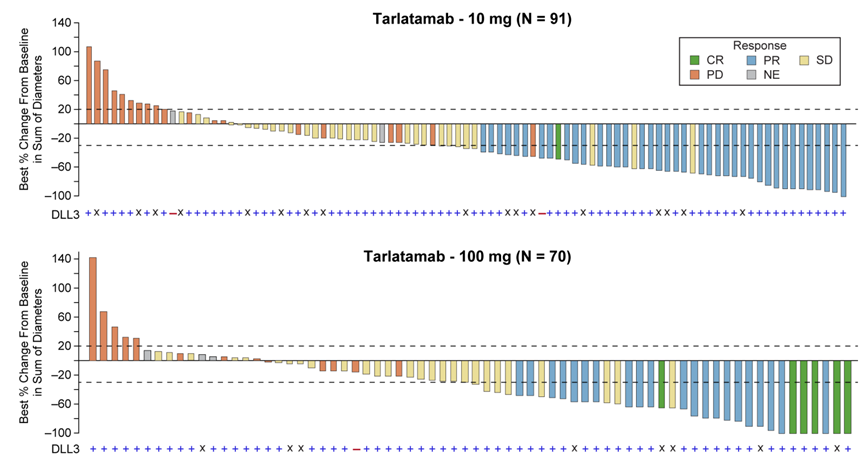
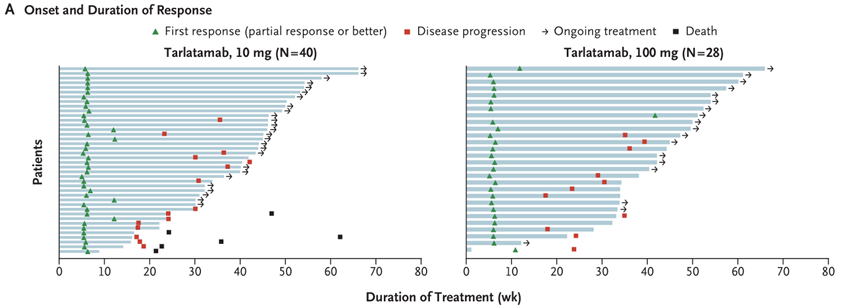
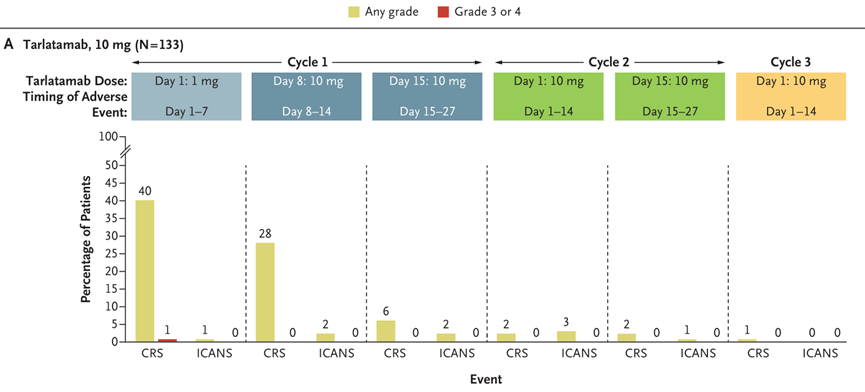
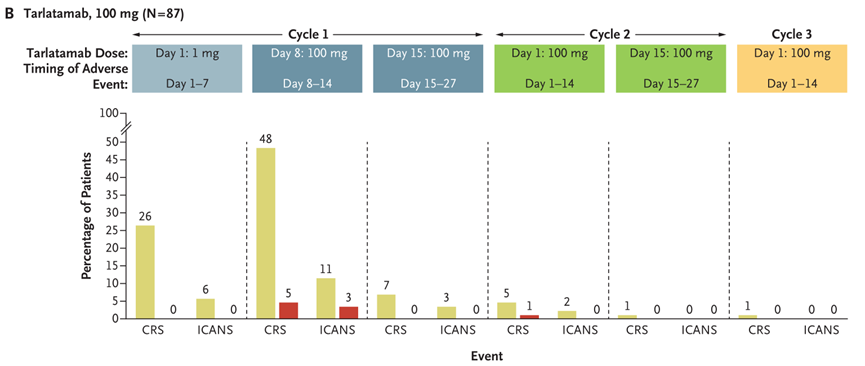
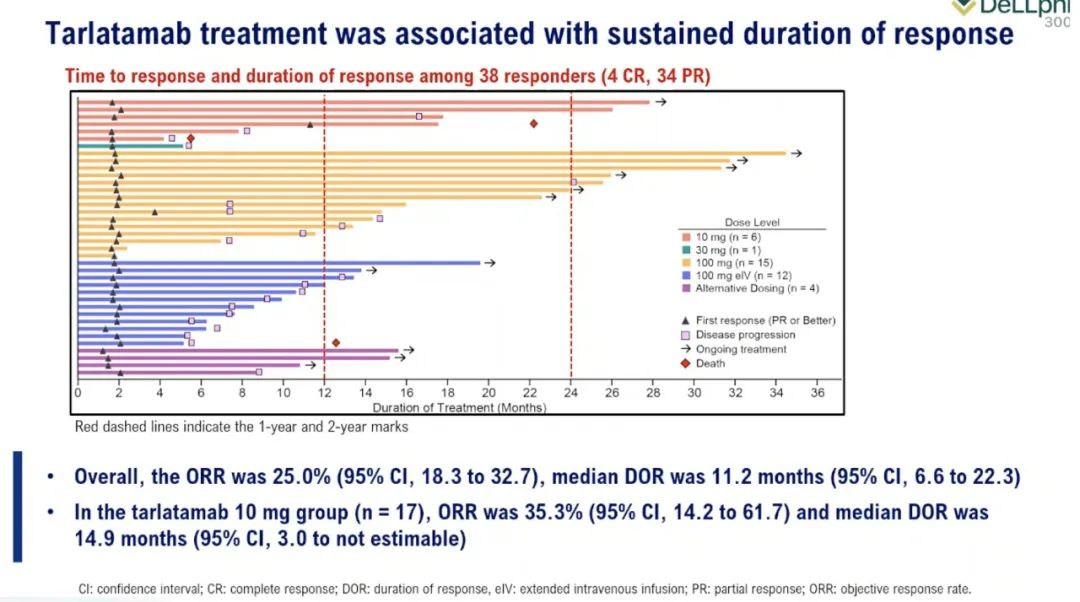
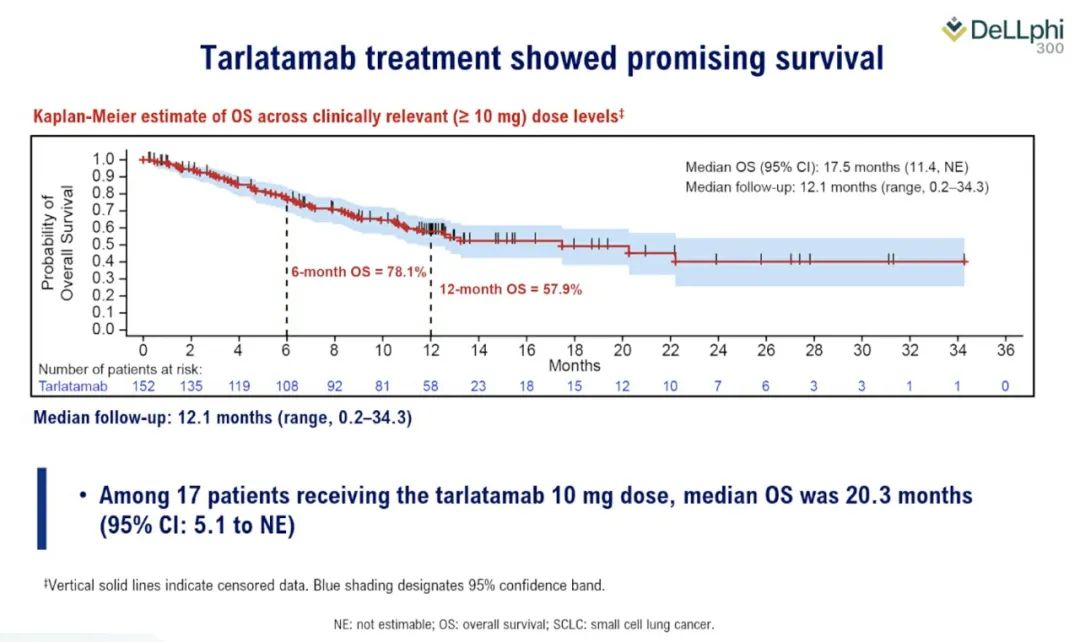
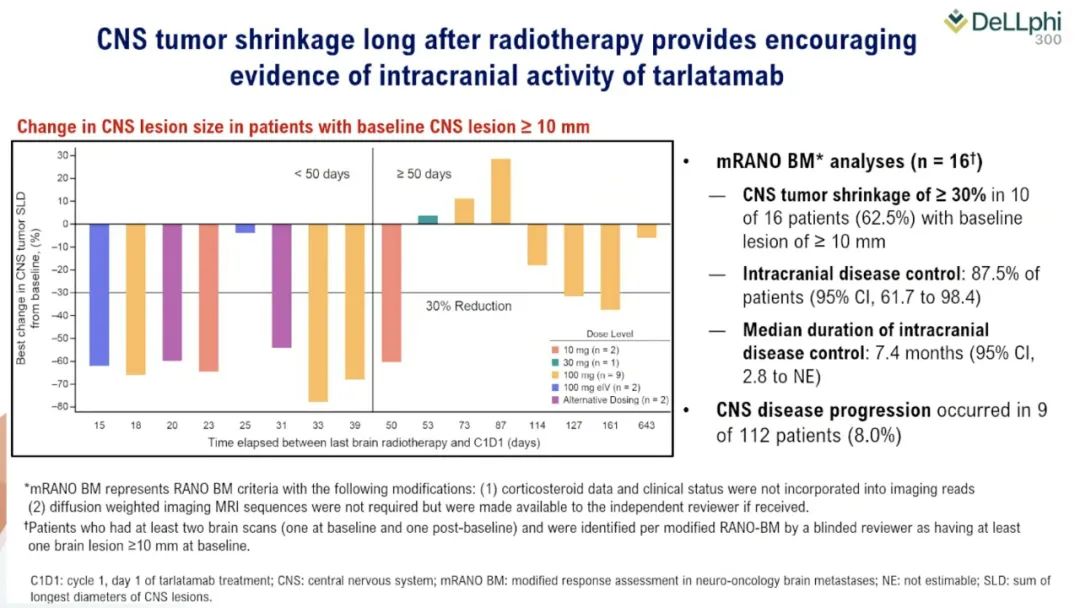
DeLLphi-301是一项国际多中心、开放标签的II期临床试验,研究纳入年龄≥18岁、ECOG PS评分为0或1、既往接受过一种铂类药物治疗或至少一种其他治疗方案的复发或难治性广泛期SCLC患者为研究对象。研究分三部分,第一部分纳入176例患者,以1:1的比例分为两组,分别接受10mg和100mg剂量的Tarlatamab治疗;第二部分为10mg组的剂量扩展研究,纳入12例患者;第三部分缩短了住院监护时间(从48小时减至24小时),10mg剂量,纳入34例患者。

本篇文章来源于微信公众号: 希望树