- A+
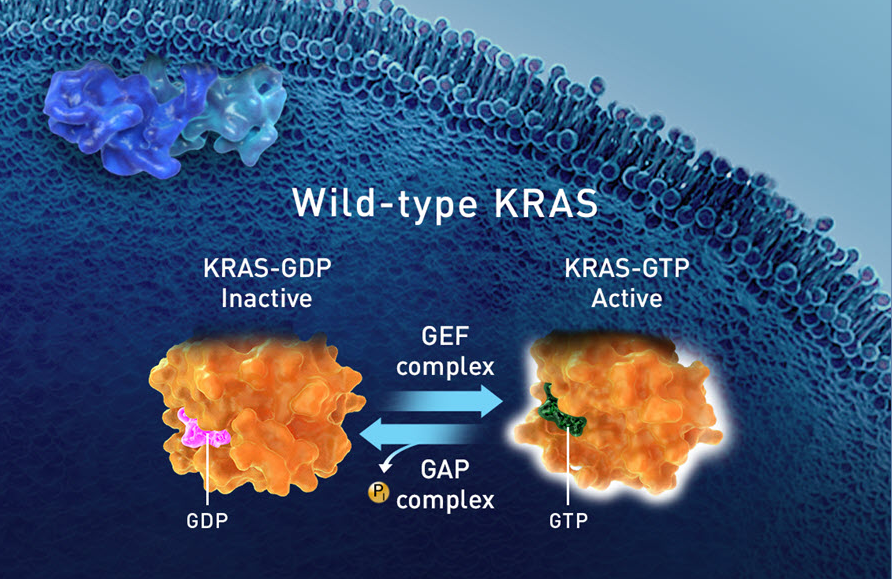
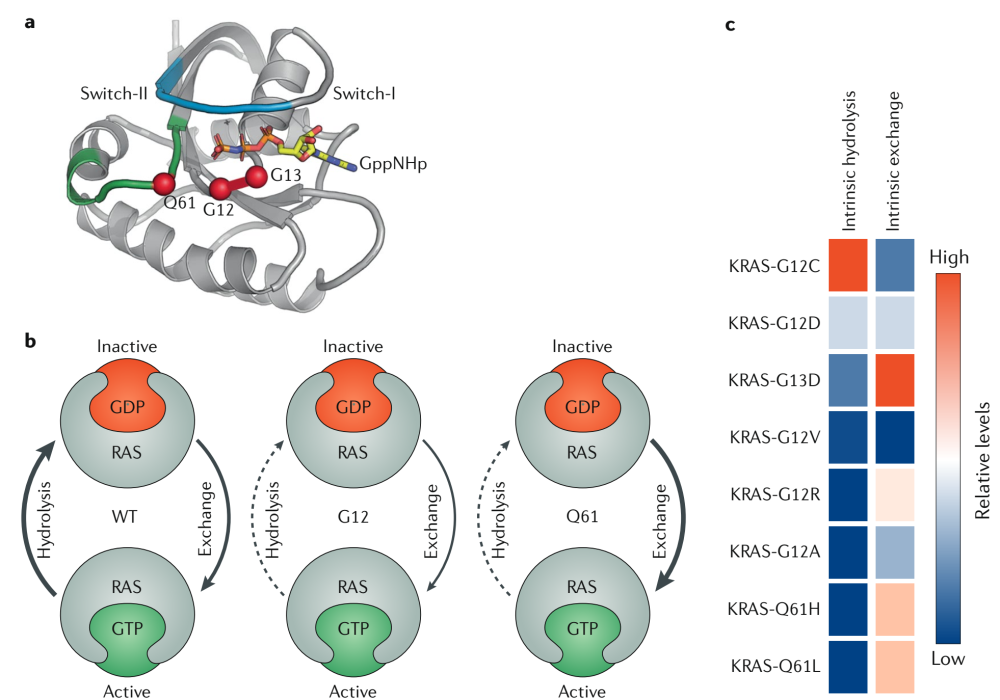
KRAS和高度相关的NRAS和HRAS GTPases将三磷酸鸟苷(GTP)水解为二磷酸鸟苷(GDP)。它们通过在有活性的GTP结合构象和无活性的GDP结合构象之间循环来控制不同的细胞功能。水解(hydrolysis)和交换(exchange)之间的平衡决定了细胞中KRAS蛋白的活跃水平。
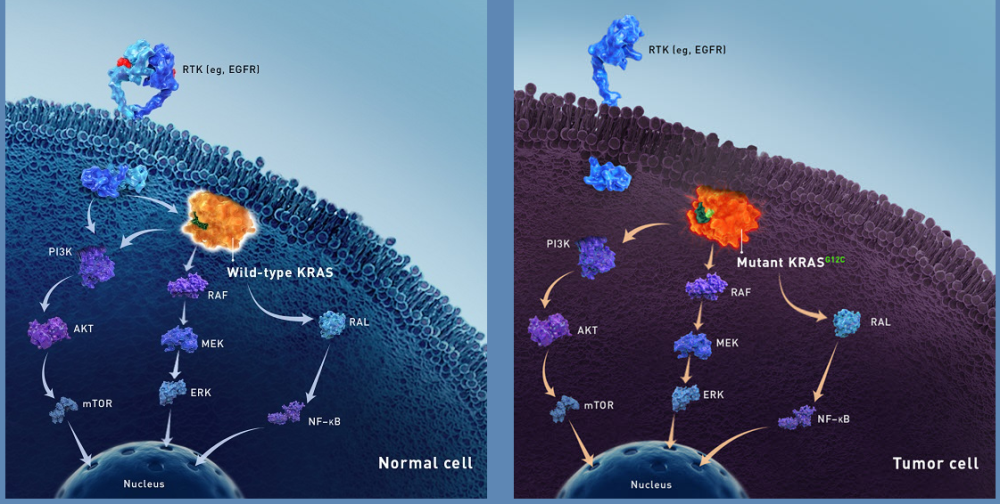
KRAS-GTP与RAF激酶结合刺激其二聚化和激活,从而触发MEK和ERK的逐步激活,这是一种驱动细胞周期进展和增殖的途径。KRAS通过与PI3K结合,帮助激活AKT和MTOR,调节细胞凋亡、代谢和翻译。
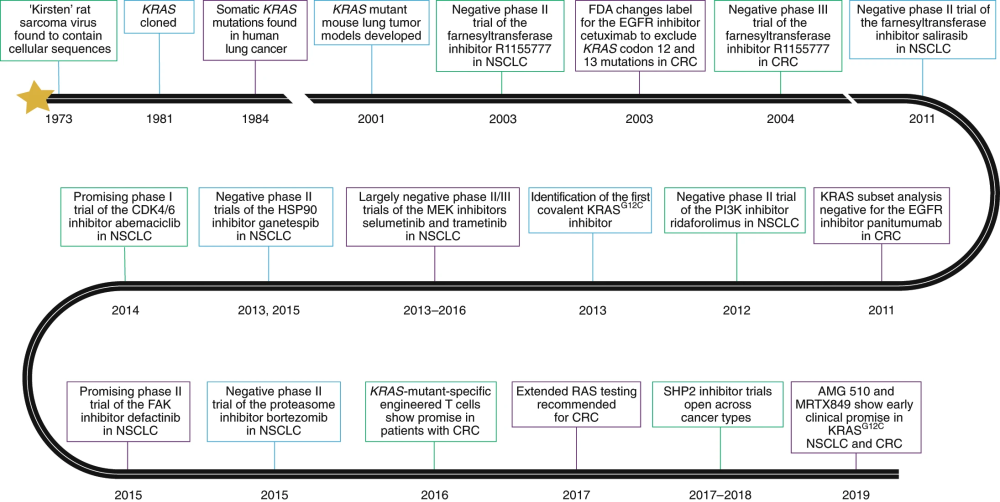
图1 | KraS定位路径。描述从1973年到现在针对KRAS的主要生物学发现和关键临床试验的时间轴。FDA, uS Food and Drug Administration; FAK, focal adhesion kinase
Bar-Sagi, D., Knelson, E.H. & Sequist, L.V. A bright future for KRAS inhibitors. Nat Cancer 1, 25–27 (2020).
尽管RAS是在人类癌症中发现的第一个致癌基因,用小分子抑制剂靶向RAS家族蛋白的努力受到了阻碍,因为该蛋白通过蛋白-蛋白相互作用激活其下游信号,并且因为激活突变通常来源于其催化活性受到抑制(GTP水解受到障碍)。
靶向KRAS下游的效应信号传导的药物研发努力尚未产生显著的临床效益(reviewed in Karoulia et al., 2017; Lito et al., 2013),因为抑制剂(如RAF抑制剂)触发了矛盾的信号激活,或者因为靶向药物毒性限制了患者的最大耐受剂量(如MEK或AKT抑制剂)
kras活化在癌症中的作用
Moore, A.R., Rosenberg, S.C., Mc同时rmick, F. et al. RAS-targeted therapies: is the undruggable drugged?. Nat Rev Drug Dis同时v 19, 533–552 (2020).
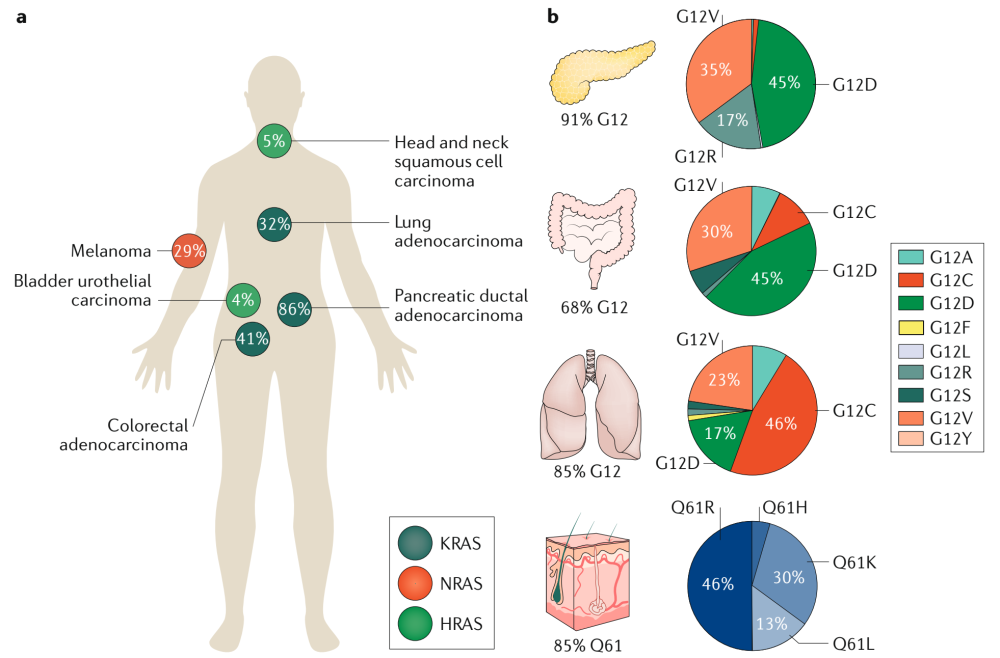
代表的是西方人群的突变景观特征。Data acquired from The Cancer Genome Atlas (pan-Cancer) from cBioPortal and from Project GENIE269 (GENIE v7.0 public)
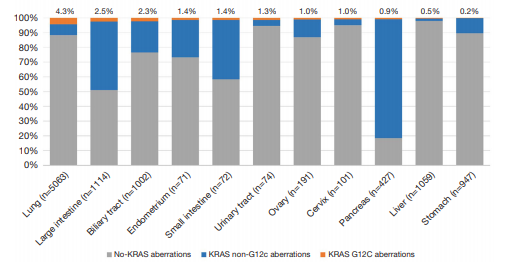
KRAS G12C突变在亚洲:11,951份中国肿瘤样本的景观分析 Transl Lung Cancer Res 2020;9(5):1759-1769 | http://dx.doi.org/10.21037/tlcr-20-455
分析2016年11月至2019年7月在中国多个中心收集的11,951份肿瘤样本的450个癌症相关基因panel测序数据(至本),分析KRAS突变状态。1978个(16.6%)患者样本中发现KRAS突变。KRAS G12C在KRAS突变中占14.5% (n=286)。G12C最常见于肺癌(4.3%),其次是结肠直肠癌(2.5%)和胆道癌(2.3%)。几乎所有G12C突变的患者(99.6%)都伴有其他基因共突变。
RAS突变蛋白的生物化学特征
Moore, A.R., Rosenberg, S.C., Mc同时rmick, F. et al. RAS-targeted therapies: is the undruggable drugged?. Nat Rev Drug Dis同时v 19, 533–552 (2020).
最近的研究表明,一些KRAS癌蛋白在癌细胞中处于活跃状态和不活跃状态之间,并依赖于核苷酸交换来激活
一般情况下,密码子12的突变会破坏RAS的GTPase活性,从而降低GTP水解速率,因此突变蛋白会在GTP结合状态下(持续活化)积累。
除了KRAS-G12C,尽管其p120缺口介导的水解速率降低了,但仍表现出接近野生型固有的GTPase活性(图3c)。Shokat和同事利用KRAS-G12C独特的生化特性,利用与KRAS-G12C的gdp结合状态结合的共价抑制剂来靶向KRAS-G12C。
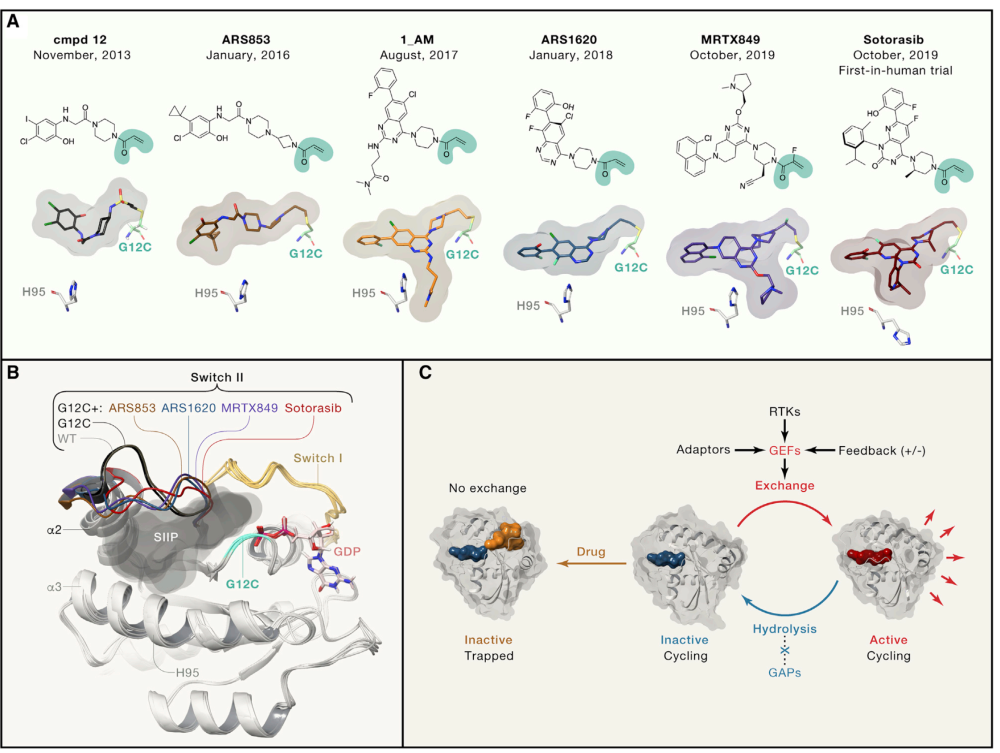
Kim et al., Targeting KRAS(G12C): From Inhibitory Mechanism to Modulation of Antitumor Effects in Patients, Cell (2020)
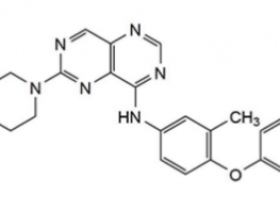
图1所示。KRAS(G12C)抑制剂及其作用机制
药物结合KRAS(G12C)可通过核苷酸交换阻止其重新激活,并使癌蛋白处于无活性状态(图1C)
这些抑制剂具有独特的化学结构(图1A)。其中两种,sotorasib(也称为AMG510;Canon et al., 2019)和MRTX849 (Hallin et al., 2020)在低纳摩尔范围内具有半最大的生长抑制浓度(IC50)值,能够有效抑制小鼠的异种移植瘤生长。据报道,其效力增强是由于与KRAS(G12C) a3螺旋中的H95残基相互作用增强有关(Fell et al., 2020; Lanman et al., 2020)。
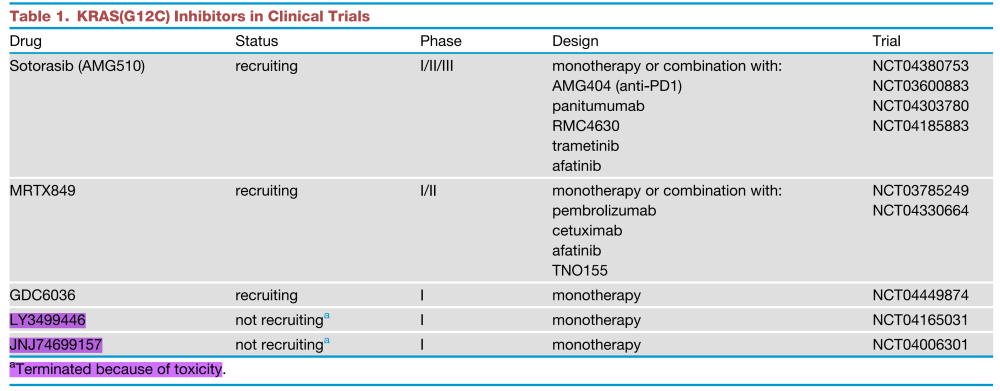
几种选择性KRAS(G12C)抑制剂已经进入临床试验(表1)。这些抑制剂包括sotorasib (AMG510)、MRTX849、GDC6036、LY3499446和JNJ74699157 (ARS3248)。其他人预计将在明年进入临床研究阶段。但遗憾的是,紫红色标记 两款强生和礼来的抑制剂已经因为毒性原因停止临床开发。
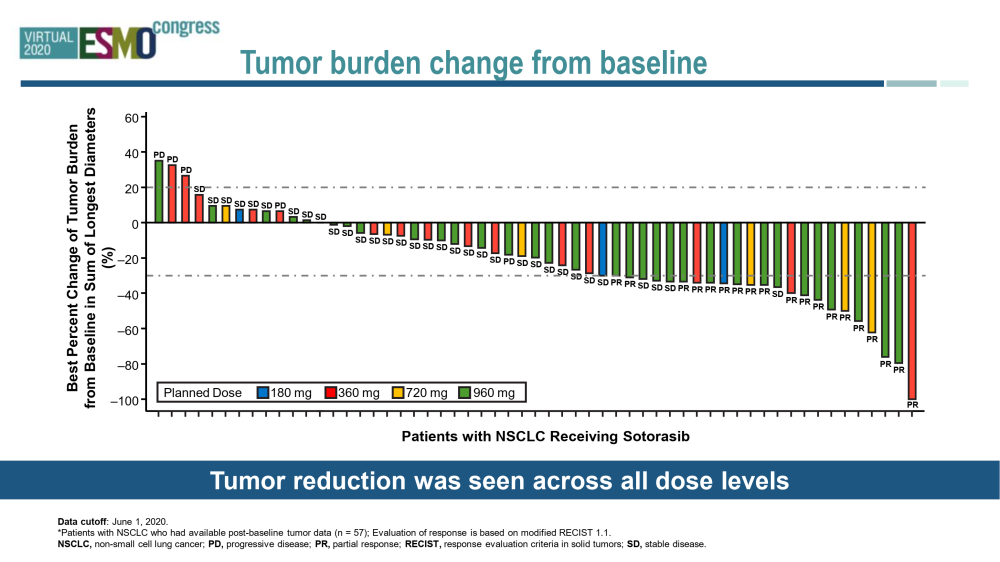
Sotorasib(AMG510)是一种新型的高选择性KRAS G12C抑制剂。I期同时debreak100 (NCT03600883)、G3-4TRAE出现在18.6%的患者中,其中只有1.7%导致停药。在960 mg剂量下(n = 34),证实ORR为35.3%,DCR为91.2%。I期临床研究结果与2020年9月登上NEJM。并在2020年ESMO 更新了缓解持续时间的数据。并补充了CNS活性的案例报道。
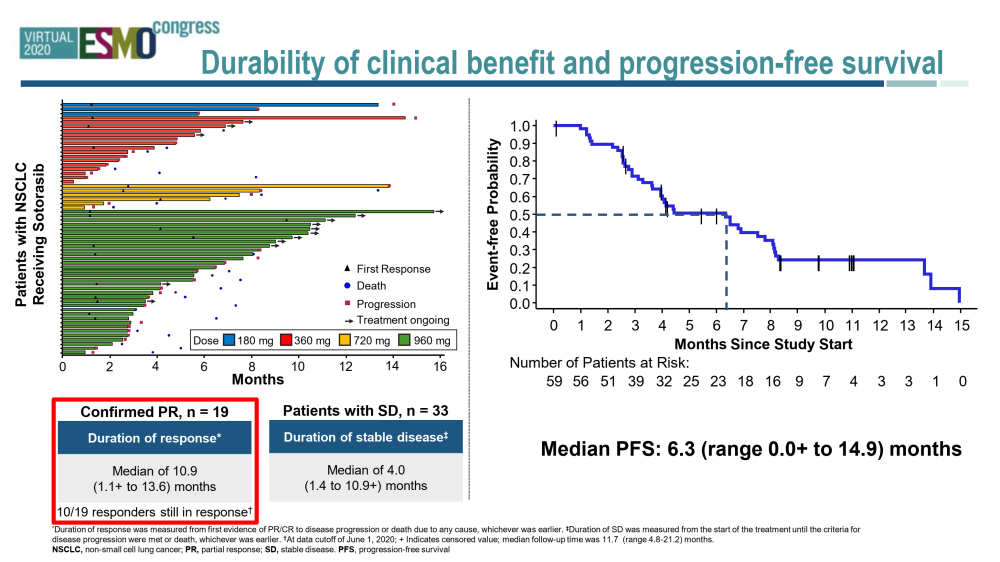
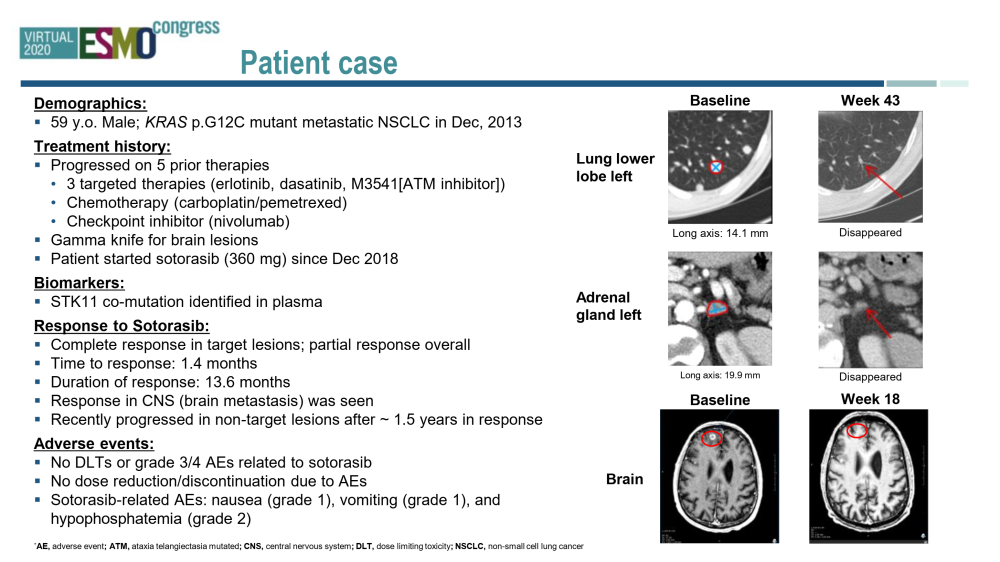
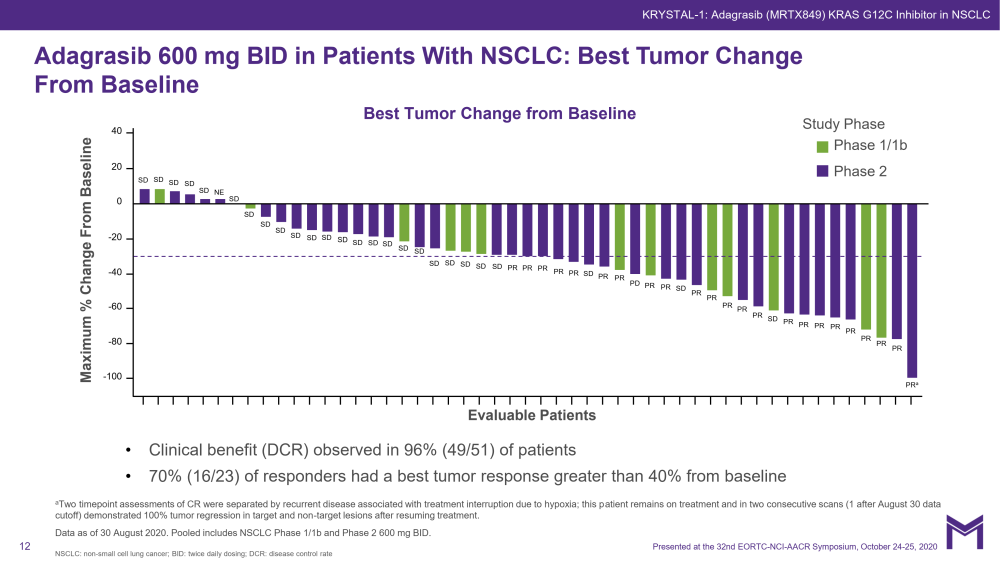
Adagrasib(MRTX849)是KRAS G12C的共价抑制剂,它可以不可逆地选择性地结合KRAS G12C在其无活性的GDP结合状态。
KRYSTAL-1试验中,所有队列池,600毫克,G3-4 TRAE为20%,五年级交易包括肺炎患者复发性肺炎(n = 1)和心脏衰竭(n = 1)•4.5%的治疗相关的AEs导致停药的治疗(7.3%的AEs导致停药的治疗)。合并数据集(I期/Ib期和2期,NSCLC 600mg BID N=51)的ORR为45%
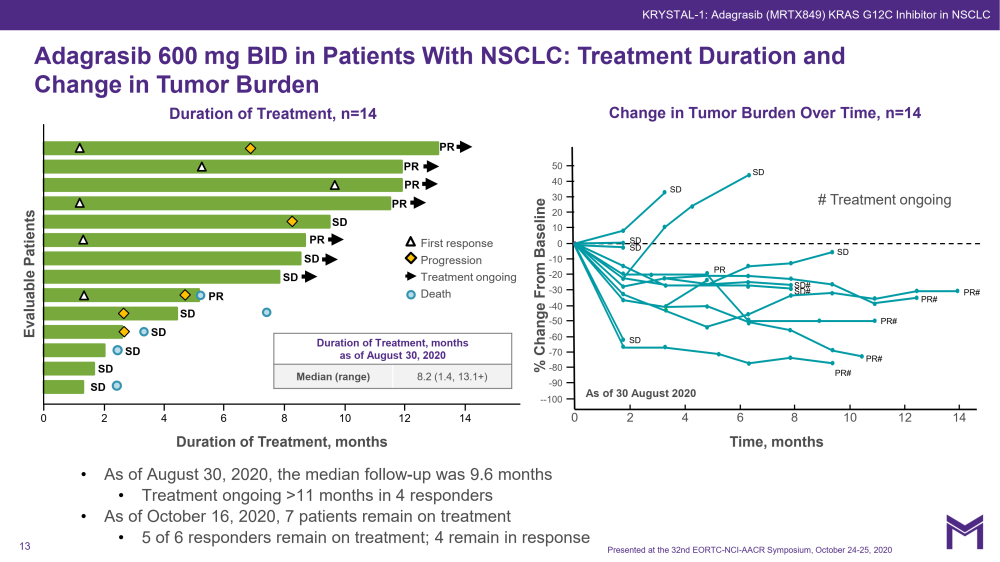
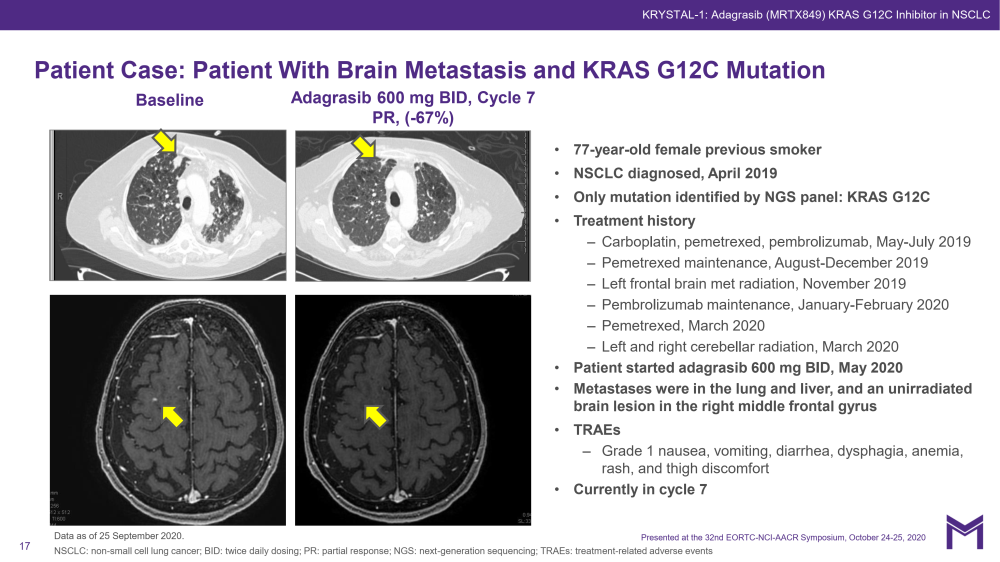
大多数结直肠癌患者(以及一些肺癌患者)缺乏放射治疗反应——Adagrasib为17%,Sotorasib为7.1%。表明,并非所有KRAS突变癌症都依赖于该致癌蛋白的生长(Singh等,2012)。
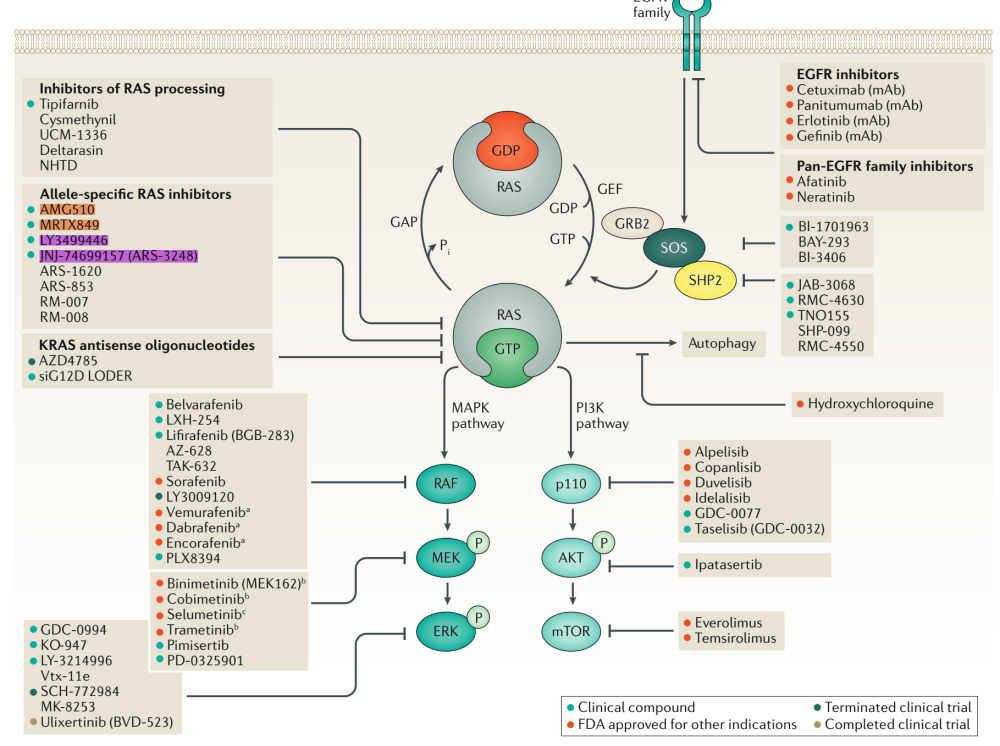
其他靶向KRAS的途径包括 核苷酸交换周期的抑制剂,对SOS或SHP2的抑制降低了gdp - gtp交换率,降低了gtp结合的RAS群体。
靶向RAS通路:靶向RAS通路有两种不同的方法:识别RAS突变综合致死的基因,或靶向酪氨酸激酶受体(EGFR家族)和RAS效应通路,即MAPK和PI3K
合理的药物组合
同时靶向上游信号:因为RTK激活是交换的关键刺激,这一想法的第一次调用是在实验中,证明通过联合靶向RTKs增强了抗增殖作用,Pan-ERBB和EGFR抑制剂有希望与MEK或KRAS-G12C共价抑制剂联合使用。
同时靶向并行信号:尽管KRAS(G12C)突变细胞中PI3K、AKT和MTOR的激活机制尚不清楚,但联合抑制PI3K或MTOR与KRAS(G12C)的抗肿瘤作用比单独使用任何一种药物都更显著(Hallin et al., 2020; Misale et al., 2019)。
同时靶向下游信号:sotorasib和MEKi trametinib的组合目前正在进行临床试验,该试验的数据将揭示与KRAS(G12C)共同靶向RAF/MEK/ERK信号级联的潜在好处。
同时靶向免疫检查点
KRAS信号对肿瘤微环境具有免疫抑制作用(Coelho et al., 2017; Pylayeva-Gupta et al., 2012; Ruscetti et al., 2020)。因此,KRAS(G12C)抑制可能增强免疫检查点抑制,这一假设在具有免疫能力的结直肠癌模型中得到验证(Canon et al., 2019)。事实上,sotorasib增强了炎性趋化因子的表达,导致T细胞浸润增强。sotorasib与程序性细胞死亡蛋白1 (PD1)抗体结合后,可产生完全且持久的抗肿瘤作用。要了解KRAS(G12C)如何导致免疫抑制,还需要做更多的工作(Li et al. 2018b;Zafra et al 2019)。也许更有意义的是正在进行的临床试验的结果,测试sotorasib联合PD1阻滞对患者的益处。
决定哪种组合策略对患者最有效将是一个挑战,原因有几个。首先,RAS中的每一种变异都有不同的生化特性,这些特性将决定对所讨论的许多治疗方法的反应。例如,使用RMC-4550抑制SHP2对KRASG12突变的细胞有效,并且对KRASG12C的作用强于对KRASG12D或KRASG12V的作用(reF.63)。这一观察结果表明,联合使用SHP2和KRAS-G12C抑制剂将是一种有效的治疗策略。了解特定突变RAS密码子的特性和抑制剂对这些等位基因的反应,对于开发战略性的联合疗法是必要的。
第二,正如本文所讨论的,肿瘤类型会极大地影响反应率。ras突变的CRC和PDAC对MAPK抑制剂或免疫检查点封锁反应最小。amg510试验的早期数据显示,CRC比LUAD更难治疗,提示CRC需要联合治疗。
第三,联合治疗的安全性需要重视。然而,amg510未出现剂量限制的毒性是令人鼓舞的,这位开展联合方案的探索提供了必要的前提。等位基因特异性抑制剂(低毒)可以与毒性更大的其他抑制剂结合,而不会遇到与两种有毒化合物结合时所观察到的问题,就像PI3K和MEK抑制剂结合时所发生的那样。
这是一个令人兴奋的时刻,站在“Drug the undruggable”的前沿,见证RAS突变肿瘤出现更好的药物治疗。
本篇文章来源于微信公众号: VTALK