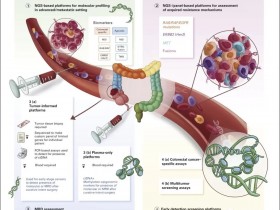
- A+


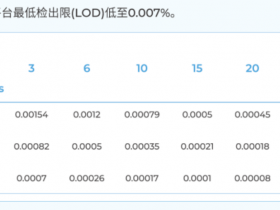
-
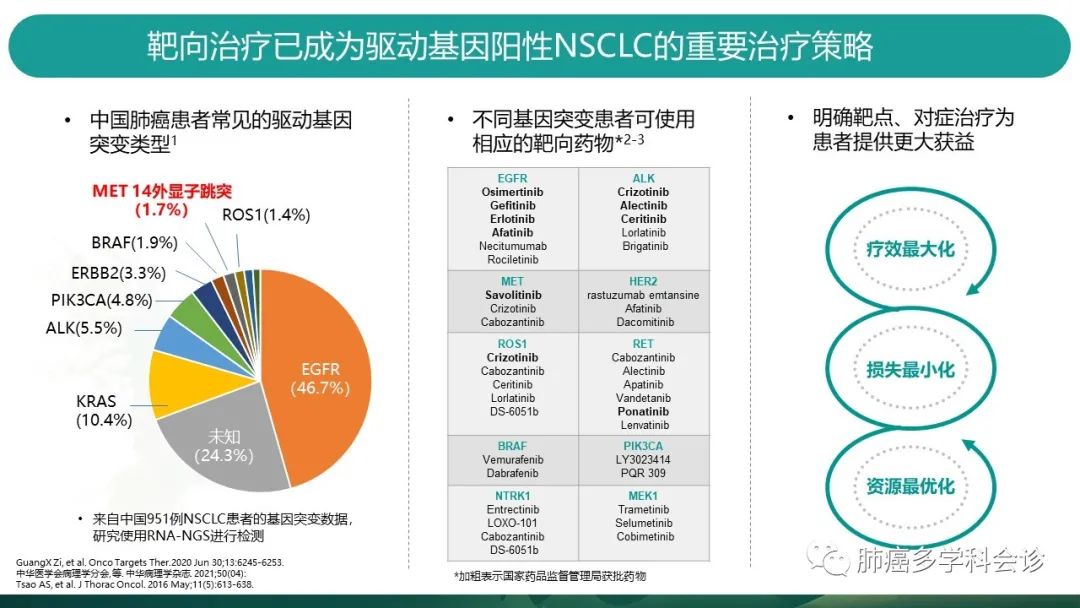
多项大规模临床研究证实,包括MET在内的多个驱动基因,均与肺癌患者的靶向治疗相关,而靶向治疗可及的药物也越来越多。 -
从一项951例NSCLC患者的基因突变图谱来看,约70%的患者可找到左图中至少1个突变。 -
基于靶向治疗肺癌的疗效优势,明确靶点,对症治疗,可以给患者带来疗效最大化,损失最小化,资源最优化等获益。
-
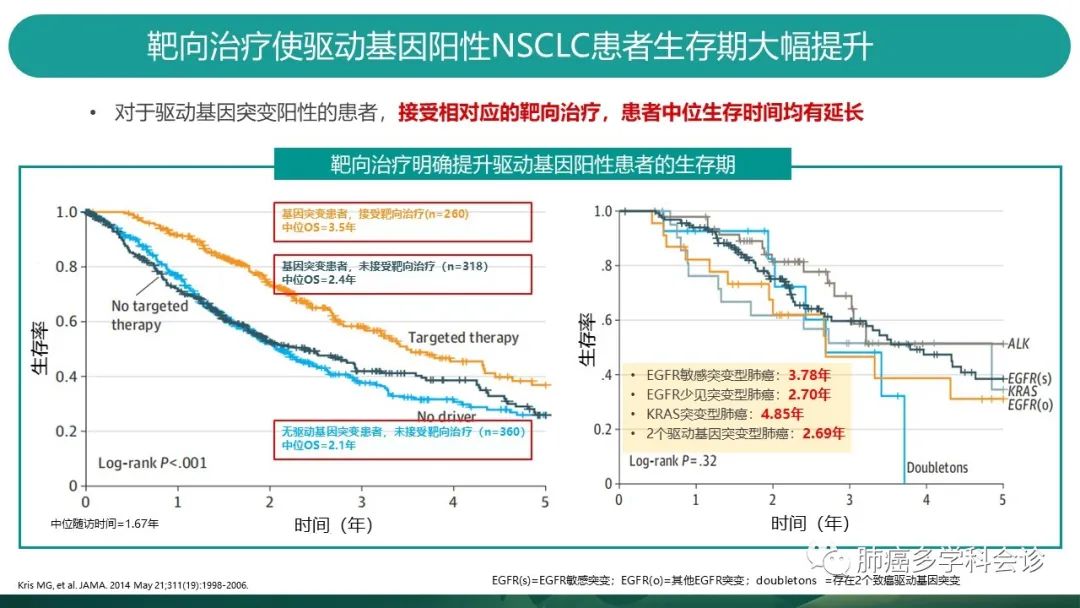
既往的多项研究已经证实了靶向治疗给驱动基因阳性的NSCLC患者带来生存获益。 -
2014年Kris等人发表在JAMA上的研究显示,基因突变的晚期肺癌患者接受了靶向治疗的中位OS可达3.5年,相比基因突变患者未接受靶向治疗的中位OS2.4年,延长了1年多的总生存! -
从突变情况分析患者OS可以看到,携带EGFR敏感突变的晚期肺癌患者总生存可达3.78年,单纯携带KRAS突变的患者中位OS可达到4.85年。而少见EGFR突变或存在2个驱动基因突变的患者,中位OS相对较短。因此,不同突变类型也关系到患者的预后。
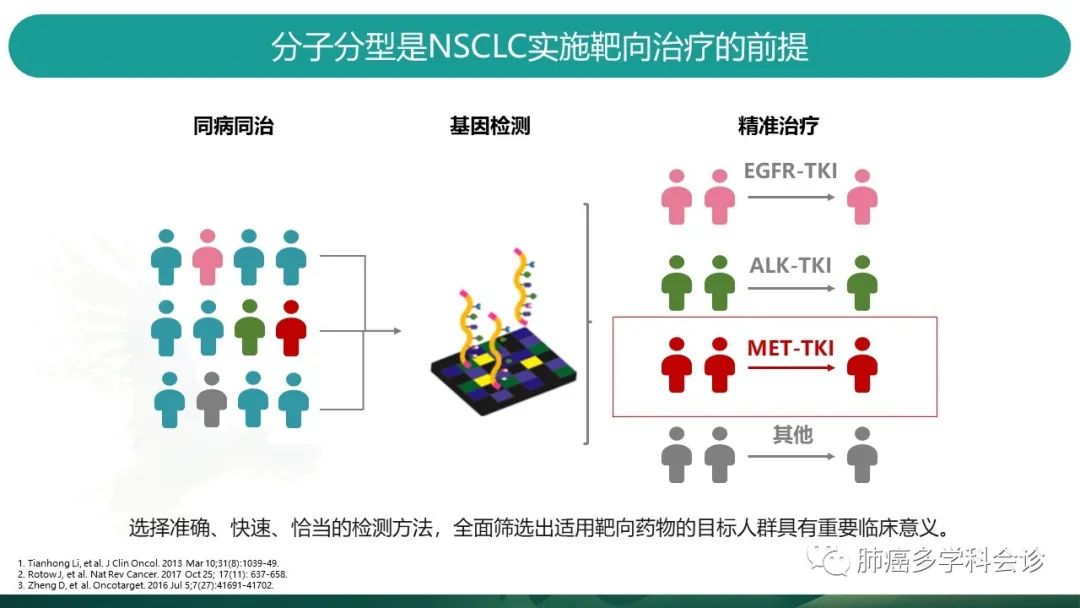
-
所以,明确分子分型,是NSCLC实施靶向治疗的前提,也能帮我们对患者的预后做出相应的预判。 -
基于基因检测技术的进步,我们临床的治疗观念,也逐步从同病同治,向更为精准的治疗迈进。
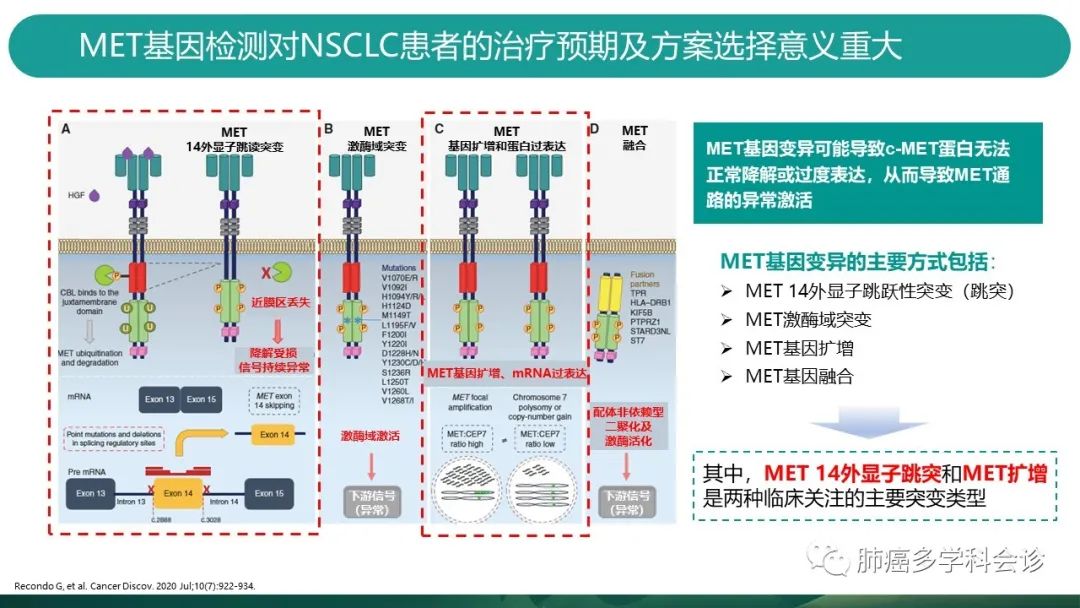
-
MET基因位于7号染色体的长臂,包含了21个外显子。它编码的c-MET蛋白是肝细胞生长因子(HGF)的酪氨酸激酶受体。 -
MET基因异常可能导致c-MET蛋白无法正常降解,或者过度表达,从而导致MET通路的异常激活。 -
从左图我们挨个分析MET基因变异的几种方式:
-
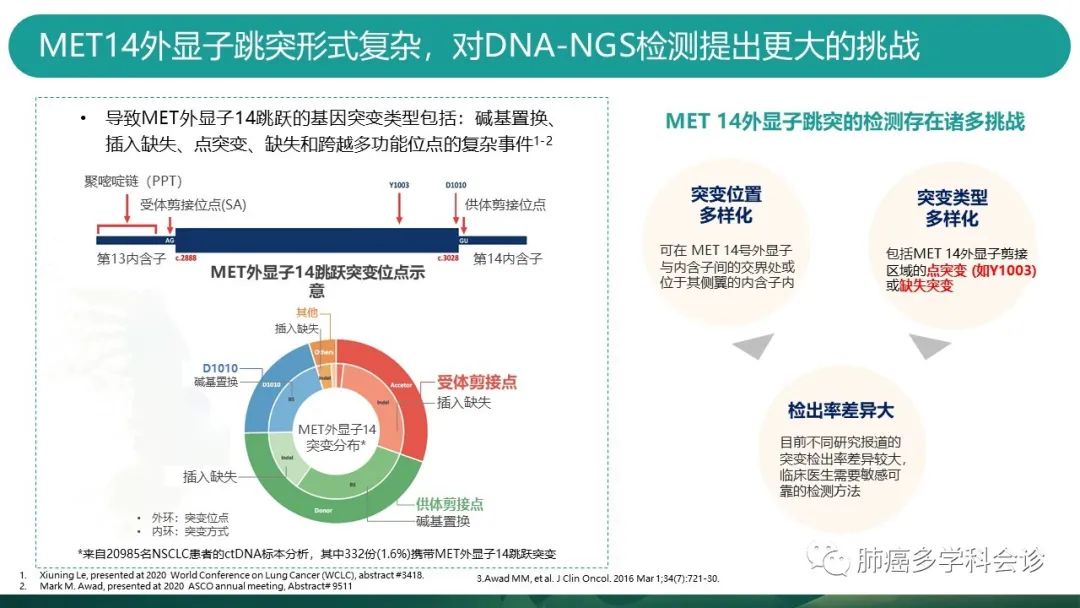
A:MET14跳突是由于MET基因14号外显子上游和下游的内含子区域发生了碱基的改变,导致合成mRNA时,14号外显子及其两端的内含子共同被剪接,以至于MET14号外显子对应的mRNA片段缺失(13号直接连到15号),MET相对应的蛋白缺失(如图A中的近膜区域的标红蛋白),这一负性调控区域缺失,将导致泛素化的酶无法与c-MET蛋白结合,影响泛素化,致使降解受损,信号持续异常。 -
B:MET激酶域的改变,类似ALK等其他基因,发生了激酶域的改变后导致激酶域持续激活,下游信号异常,细胞持续增殖存活。 -
C:MET扩增和蛋白过表达:MET基因层面发生了扩增,或多种因素导致c-MET过表达,HGF与c-MET结合,激活下游信号通路,促进细胞增殖生长迁移和血管生成等。MET扩增和MET多倍体都会产生类似的结果。 -
D:MET融合(重排):MET与其他基因发生了DNA层面的拼接,常见partners如图,受体(融合产生的新型蛋白)发生了配体非依赖型二聚化(正常应该是c-MET与HGF结合来调控信号,新型蛋白不依赖HGF),以及激酶的活化,从而导致下游信号异常。
-
临床中,基于发生率和对肿瘤发生机制的研究,我们重点关注MET14跳突和MET扩增。

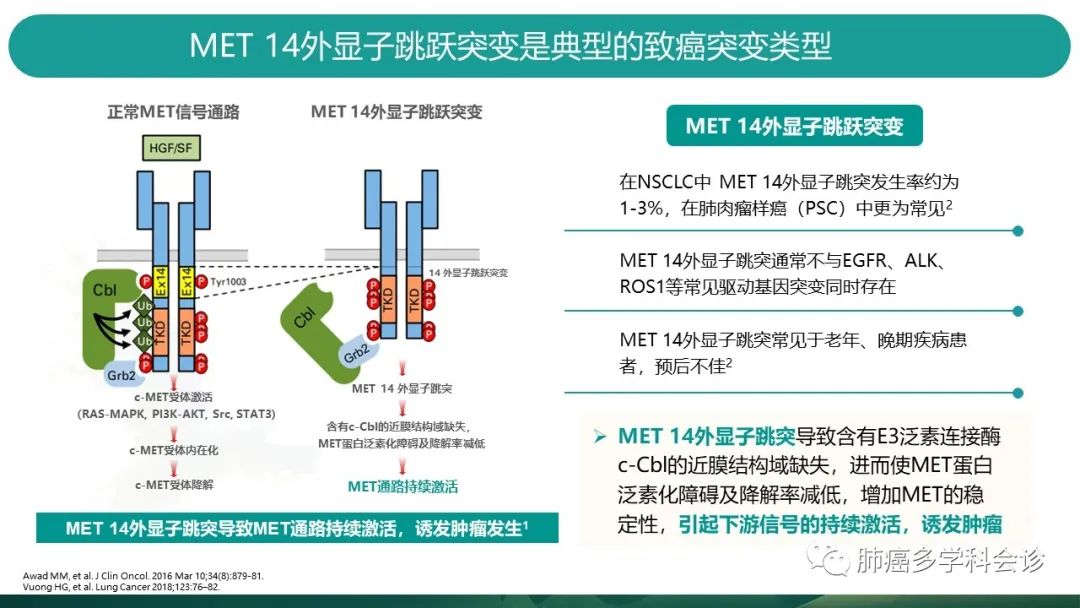
-
正常的MET信号通路如左图:配体HGF(肝细胞生长因子)或SF(散射因子)与受体c-MET结合,使得c-MET激活后,进而激活一系列下游信号通路(如RAS-MAPK, PI3K-AKT等),产生广泛的细胞反应(增殖,存活,血管生成等等)。由MET14外显子编码的近膜结构域是MET关键的负性调控区,其上E3泛素连接酶c-CBI酪氨酸结合位点(Y1003)就在此区域,参与着MET蛋白的泛素化和降解。 -
当发生MET14跳突时,其编码的关键结合位点不复存在,c-MET泛素化障碍,降解率减低,c-MET稳定性增加,引起下游信号的持续激活,最终成为致癌驱动基因。
-
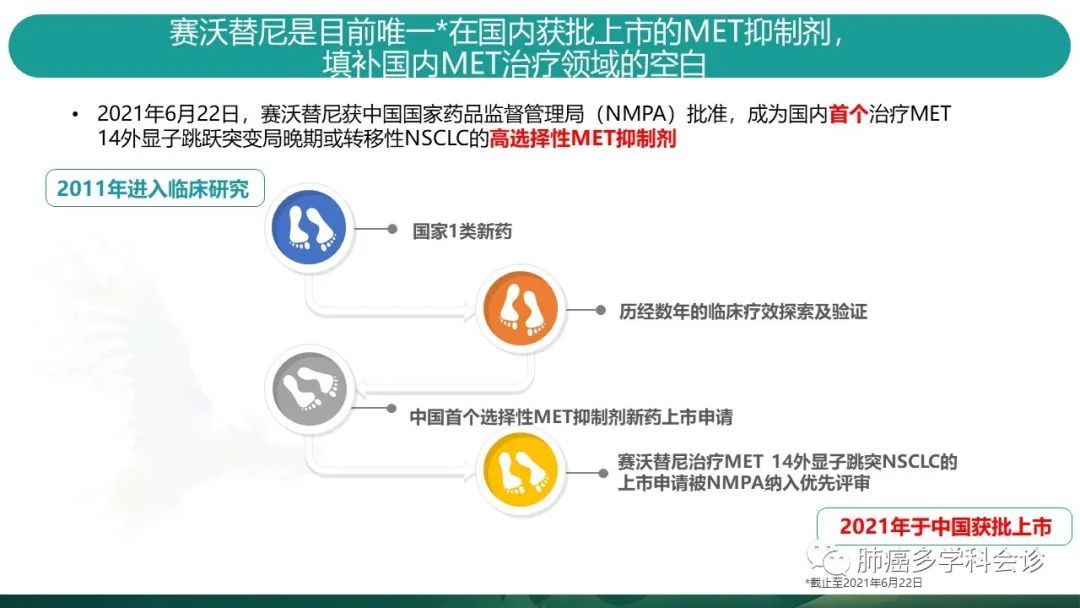
针对MET14跳突导致的肺癌,沃瑞莎2021年6.22获得NMPA批准,是高选择性的MET抑制剂。
-
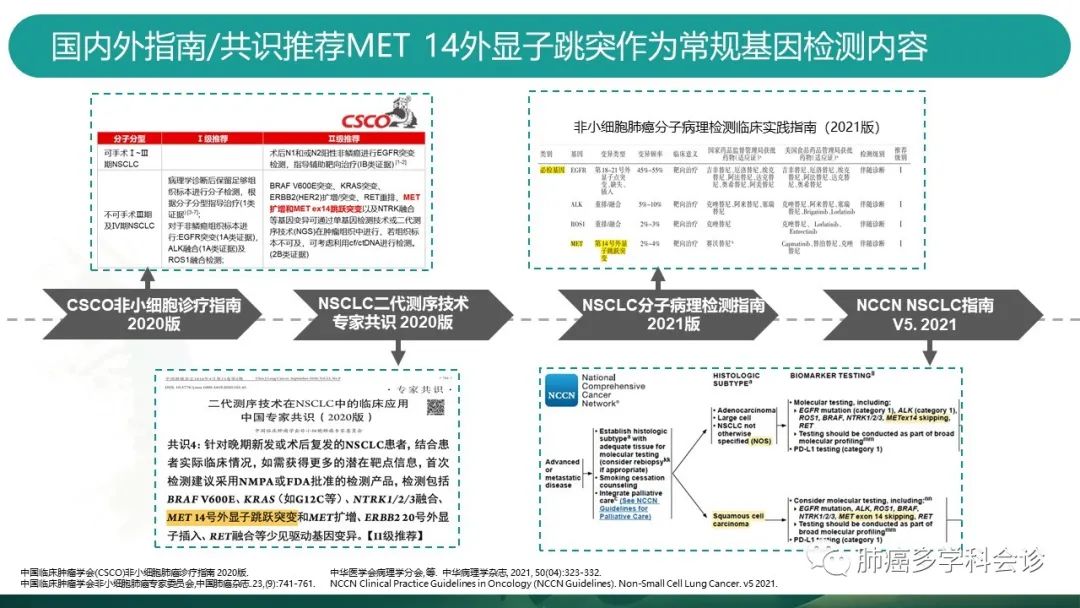
多项指南、共识均推荐应把MET14跳突作为常规基因检测内容。
-
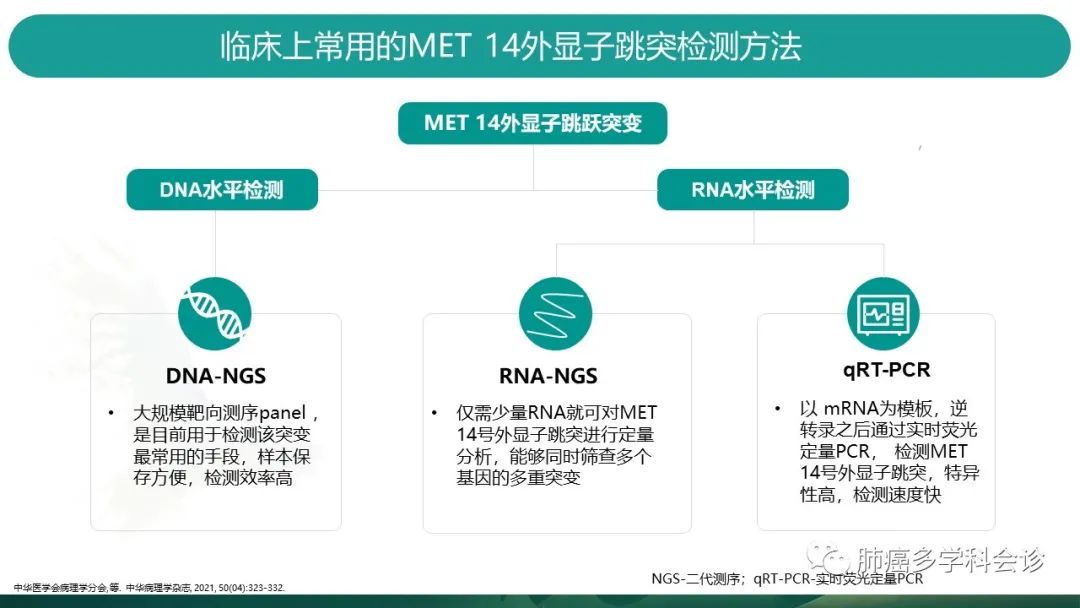
临床常用的检测方法分为DNA水平和RNA水平两种。各个方法介绍如幻灯所示。
-
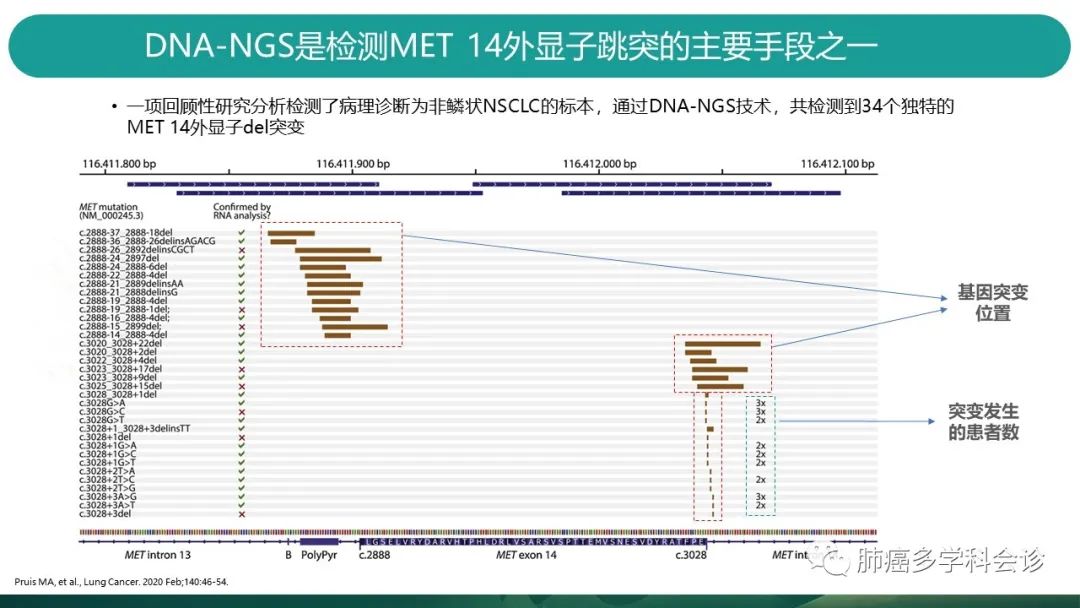
目前临床更为常用DNA based NGS。 -
2020年Lung Cancer发表的一项回顾性研究,分析了DNA-NGS方法检测MET14跳突的情况。可以看到跳突主要发生的位置在MET14号外显子上游13号内含子交接区域,以及14外显子下游交界处,或14内含子区域。
-
导致MET跳突的基因变异形式非常复杂,MET14跳突的检测存在很多挑战。
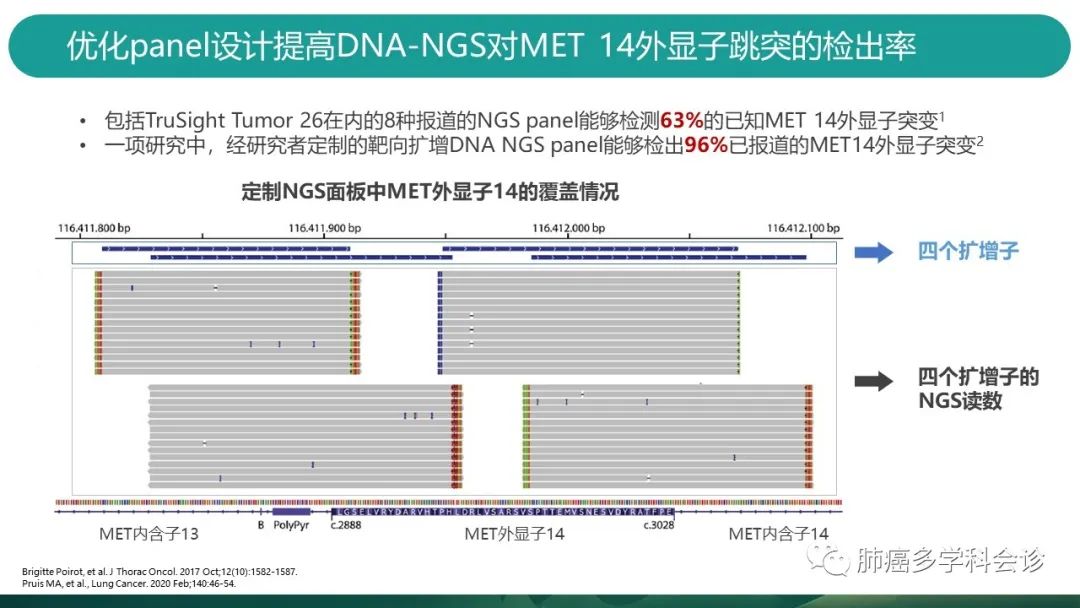
-
为了应对标本受限和目前市面上商业化的NGS面板存在局限性的问题,2020年报道的一项研究中,研究者开发了一种靶向扩增的DNA NGS面板,能够提高DNA NGS的MET外显子14跳变检出率,能够检出96%目前已被报道的MET外显子14跳变类型。
-
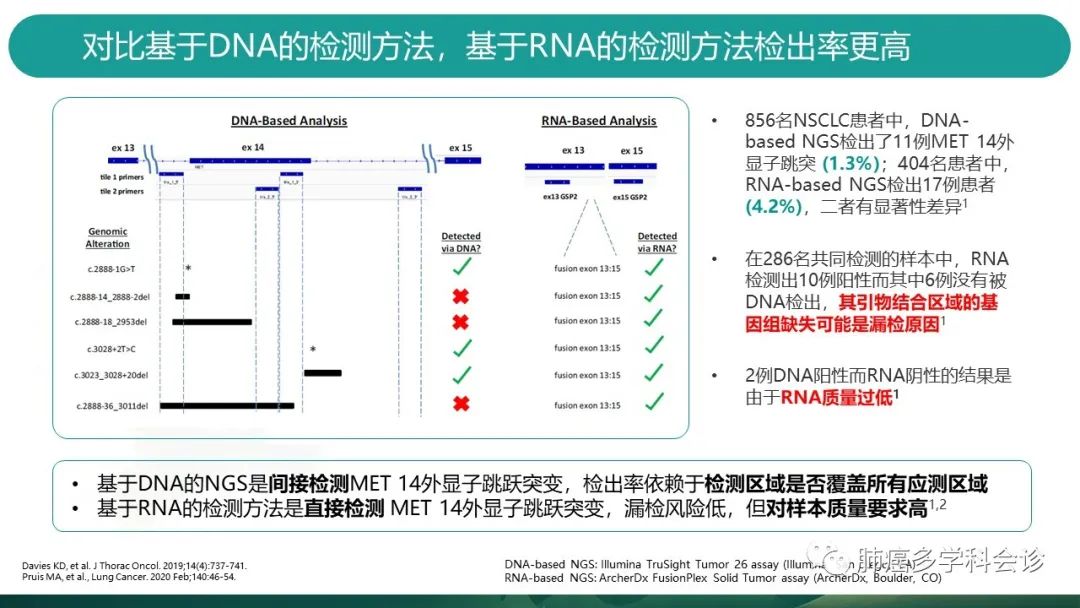
2019年JTO发表的一项研究,用DNA-NGS法检测MET14跳突,对比RNA-NGS法,发现RNA方法检出率更高且二者有显著性差异。 -
其中286名共同检测的样本中,6例RNA阳性但DNA法未检出,考虑是样本扩增时发生了基因组缺失,导致引物无法结合,产生漏检。 -
有2例DNA阳性但RNA法阴性,考虑是RNA质量过低。 -
所以,从检测方法分析,RNA是直接检测方法,检出率高,但对于样本质量有要求; -
DNA是间接检测方法,检出率依赖于检测区域是否覆盖所有应测区域
-
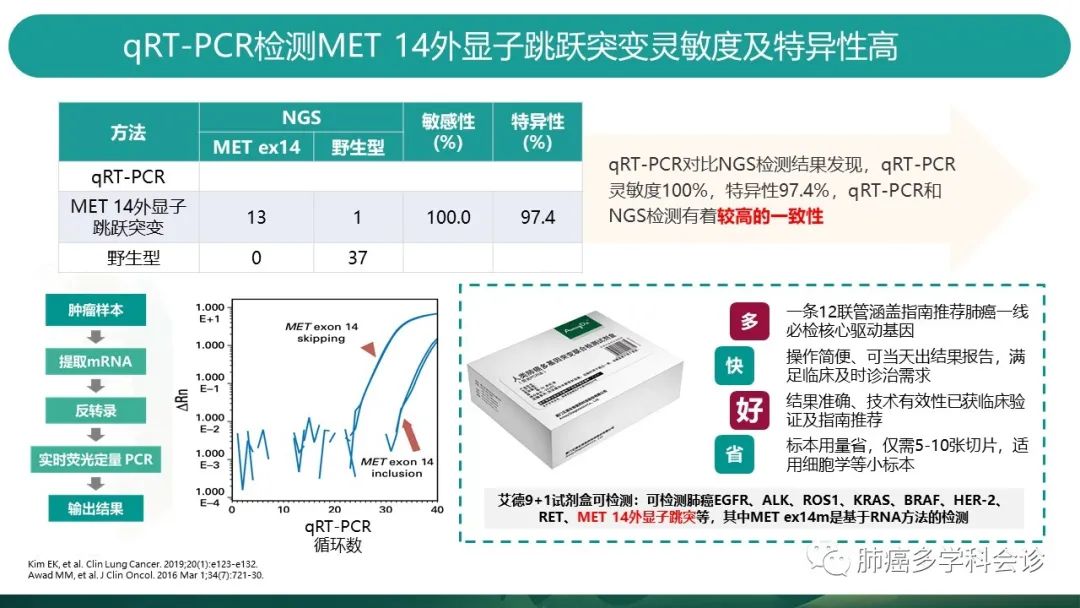
一项研究比对了qRT-pcr(反转录实时荧光定量PCR)的方法和NGS方法测MET14跳突的一致率情况。 -
NGS法检测到13个MET14跳突阳性,38个阴性。 -
qRT-PCR法,13个NGS阳性的全部检出,还检出1个NGS判定阴性的阳性患者。共14个阳性,37个阴性。 -
以NGS法为参照,qRT-PCR方法敏感性达到100%,特异性97.4%,一致性较高。 -
qRT-pcr的原理如左下图,实时荧光定量PCR检测MET相应的反转录片段,发出不同的荧光信号,提示是否存在MET14跳突,原理简单可操作性强。 -
市面上做的比较好的如艾德公司的9+1试剂盒,可同步检测肺癌刚需基因,并用测RNA的方法检测MET14跳突,结果更为快速准确。
-
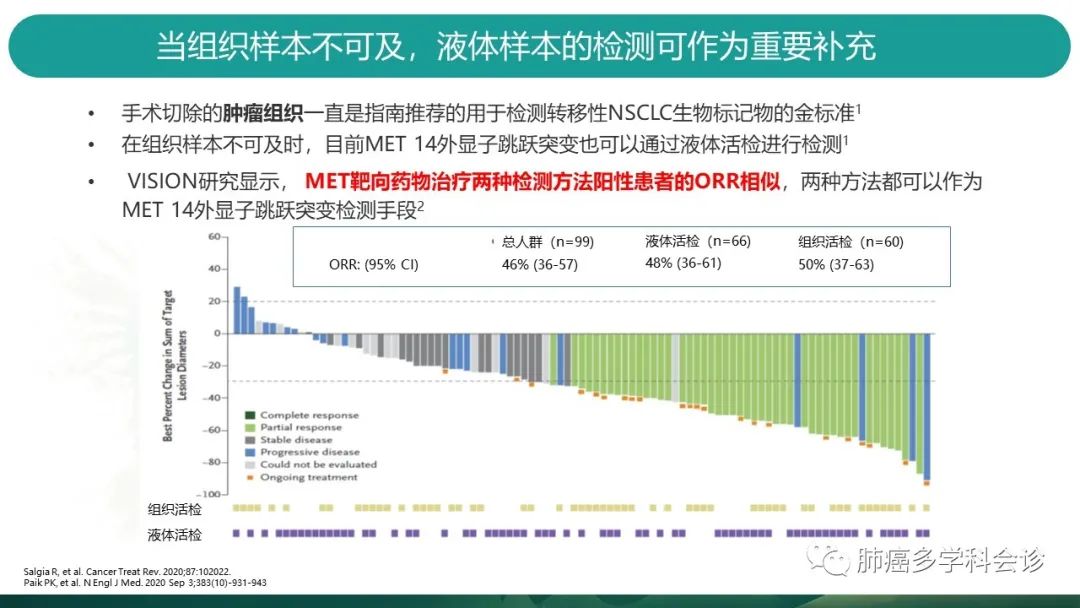
2020年发表在新英格兰杂志的VISION研究揭示了,液体活检与组织检测,无论哪种检测出MET阳性的患者,均能从MET靶向药物中获益,两种方法的ORR相近。
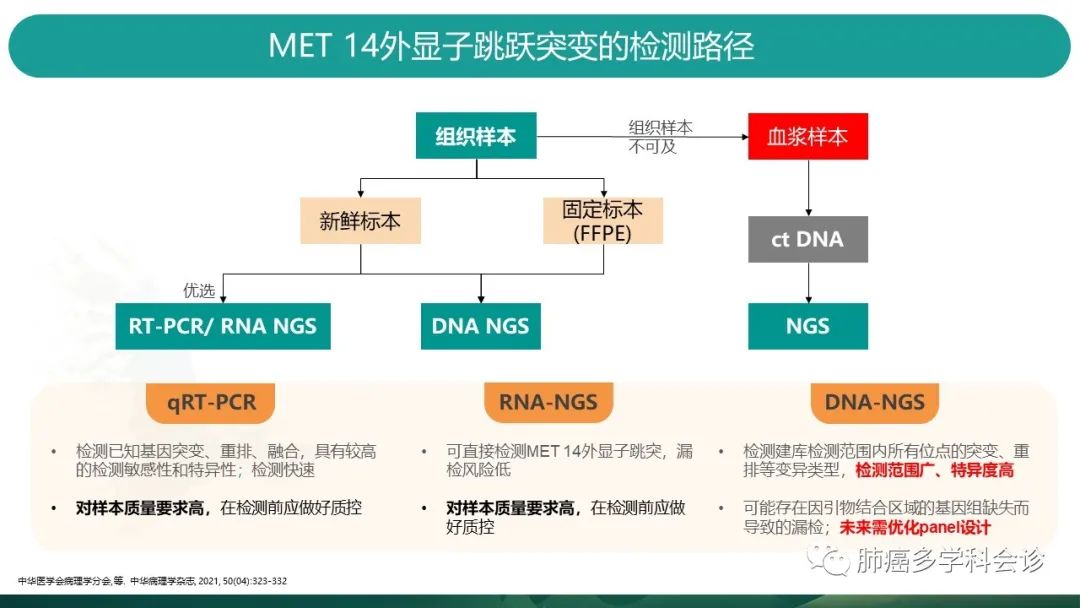
-
不同样本类型,选择检测方法的优先顺序如图。
-
各检测方法的要求也不同。

-
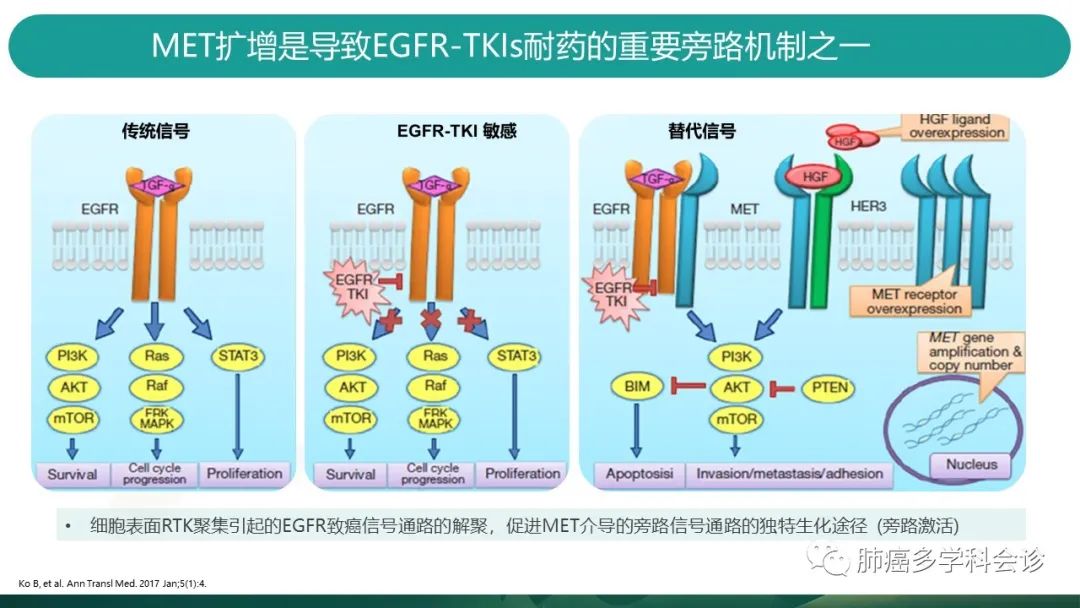
再来看看MET扩增,不同于MET14跳突,它是导致EGFR-TKIs的重要耐药机制之一。 -
当EGFR阳性患者的肿瘤细胞发生MET扩增后,EGFR-TKIs虽然抑制了EGFR通路的持续激活,但由于c-MET过表达,大量HGF与cMET结合,激活下游信号通路,导致细胞存活,侵袭和转移。 -
MET基因扩增及拷贝数变异都会造成c-MET过表达。
-
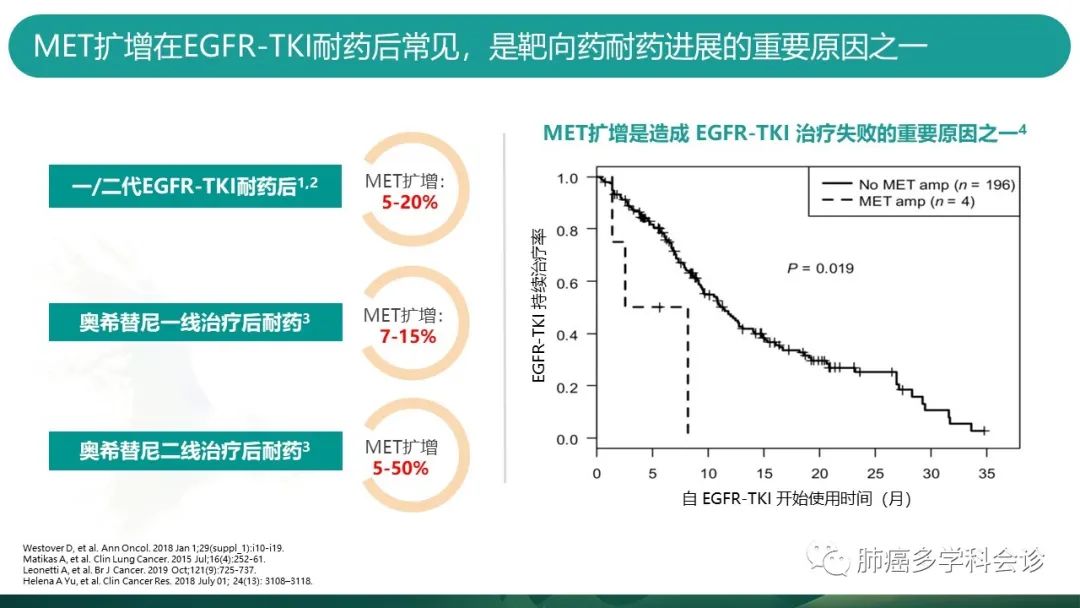
MET扩增也被认为是第三代 EGFR-TKI的又一重要耐药机制。但目前尚缺少 MET 扩增与奥希替尼耐药的大样本的队列研究。
-
一篇综述总结了EGFR突变晚期NSCLC患者奥希替尼一/二线耐药的分子机制。MET扩增分别占二线与一线奥西替尼耐药机制等5-50%和7-15%。


-
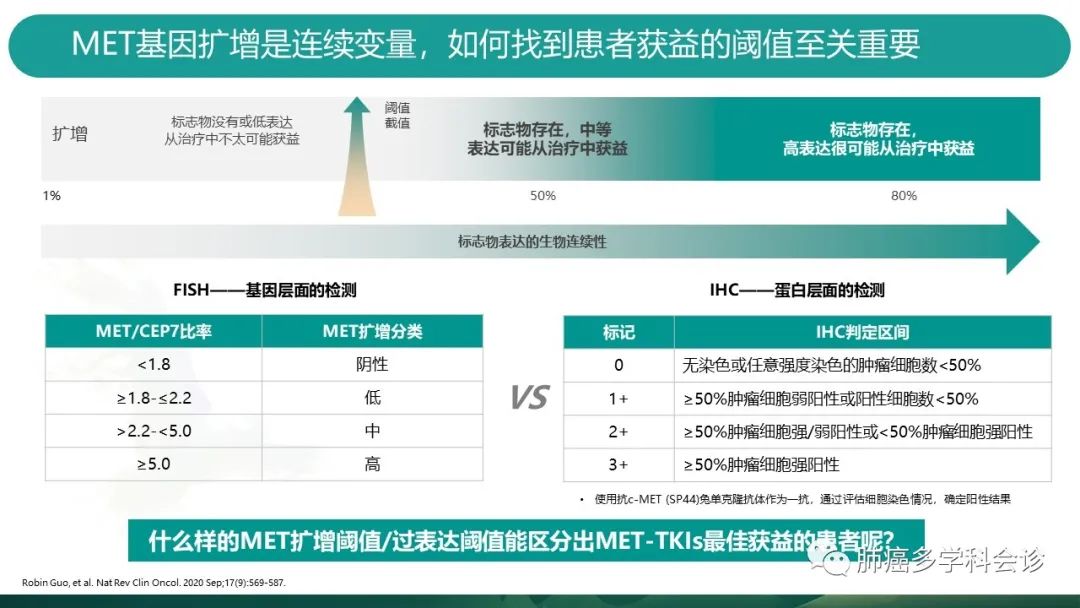
同样,cut-off值也是MET扩增中应当注意的重点。 -
FISH的方法诊断MET扩增,是通过MET荧光信号数量对比CEP7的比值来计算的,判定方法见表格。 -
IHC(免疫组化)从蛋白层面,通过特异性抗体结合的原理,通过计数染色的肿瘤细胞数,来判断阳性与否。 -
哪种界定方法能够识别出MET-TKIs的最佳获益人群呢?

首先来看FISH方法
1、左图:MET基因的拷贝数改变,有两种形式:定点扩增和多倍体。
定点扩增:人的染色体成对存在,而MET基因位于7号染色体的长臂。正常情况下单条染色体上有1个MET基因。当单条染色体上出现的MET阳性信号数/CEP7的比值≥2时,认为发生了定点扩增。
多倍体:单条染色体上的MET数量未增加,但染色体数量发生异常。判别时,当单位细胞中出现了5个及以上的MET阳性信号,但MET/CEP7<2,即为多倍体。
2、右图:基于既往的各项研究数据,大部分都使用MET GCN≥5或MET/CEP7≥2来界定MET扩增阳性,扩增越高,疗效越好。右图中虚线以上的为克唑替尼相关研究,只纳入了MET定点扩增患者。而一些选择性MET-TKI的研究同时纳入了多倍体,显示出多倍体患者也能从MET-TKI中获益。

-
NGS的检测MET扩增与FISH的判读原理是不同的。 -
NGS的阈值是不明确的。 -
FISH:可以在镜下直接观察荧光信号,计算比值。 -
NGS:在检测时,测的是正常细胞与肿瘤细胞的混合物,计算拷贝数变异时会受到肿瘤细胞占比的较大影响。

-
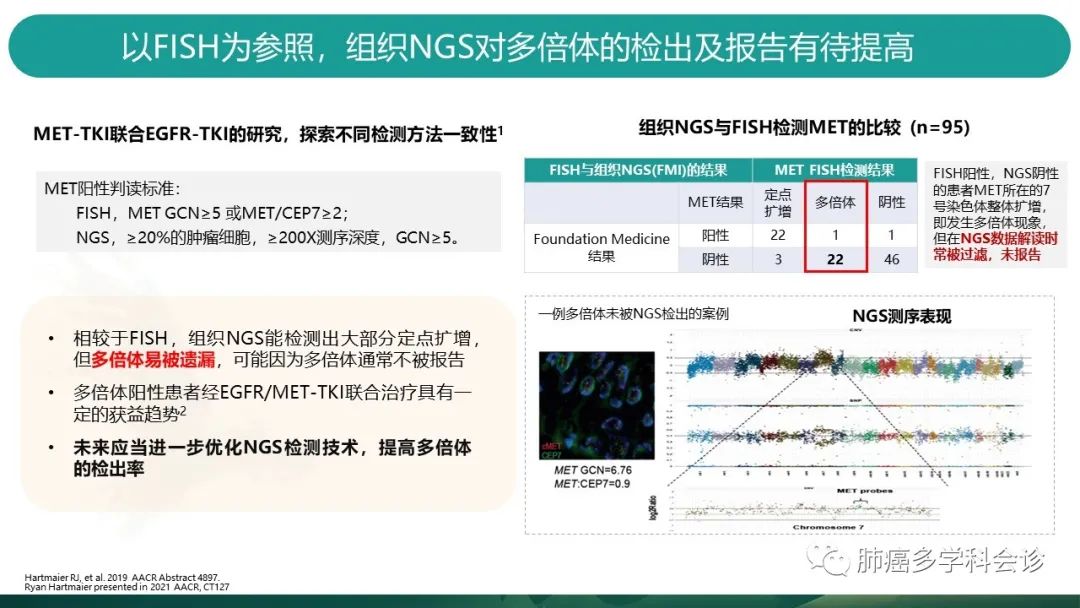
2019年AACCR发表的摘要,展示了MET-TKI联合EGFR-TKI的一项研究,探索了不同检测方法的一致性。入组患者时,以FISH方法为参照,组织NGS的敏感性达到88%,特异性98%。具体见有图表格:MET FISH方法检测出的定点扩增25例,其中22例都被NGS方法准确识别,而FISH方法测出的多倍体23例阳性患者,NGS方法仅检出1例。 -
(PPV:阳性预测值,此研究中指的是,以FISH阳性为参照,NGS检出的阳性患者中,真阳性所占的比例:真阳性/真阳性+假阳性) -
(NPV:阴性预测值,此研究中指的是以FISH阴性为参照,NGS检出阴性的患者中,真阴性所占的比例:真阴性/真阴性+假阴性) -
有限的数据中,NGS似乎不如FISH敏感,主要原因是生信分析时过滤了多染色体,漏掉了多倍体阳性的部分患者(MET序列的reads数比对正常序列reads数时,过滤掉了多倍体的情况)
-
NGS在测序时,会将测到的MET基因序列的reads数,比对正常DNA序列的reads数,当发生定点扩增时,能够准确发现扩增;当发生多倍体现象时,由于正常DNA序列reads数也发生了增多的情况,可能导致多倍体不能准确识别。(并且还会受到肿瘤细胞占比的较大影响)
-
由于多倍体阳性的患者也有从靶向药物获益的趋势,未来应当进一步优化NGS检测技术,提高多倍体的检出率。
-
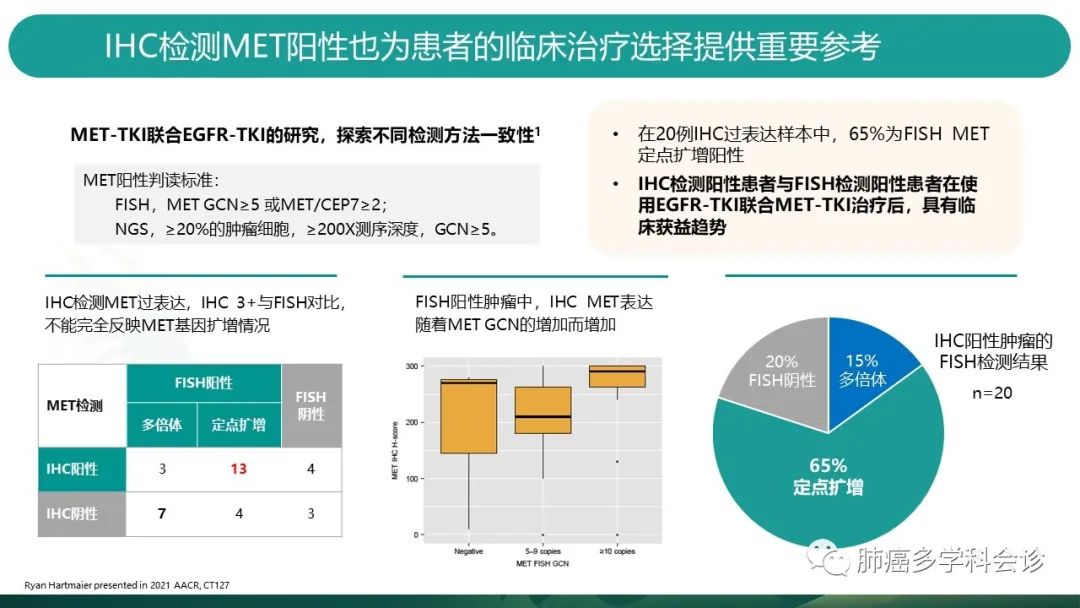
在该研究中,同样还比对了免疫组化方法检测MET扩增的情况。
-
左下图表中,免疫组化阳性的患者(20例),经FISH检测,65%为定点扩增,15%为多倍体,20%FISH判为阴性(这20%患者可能并非基因层面的改变导致的蛋白过表达);免疫组化阴性的患者(14例),FISH判读阳性的为11例(似乎FISH方法能找出更多的阳性患者?)
-
中间图标展示了,FISH阳性的患者中,MET GCN数值越高,被IHC方法判读为阳性的可能性越大。
-
从疗效上看,IHC与FISH双阳性的患者,具有临床获益的趋势。

临床中常遇到耐药患者取不到组织的情况,血液NGS方法或可作为补充检测手段。
此图中汇总了多个研究中的比对数据,分析了FISH与组织或者血液NGS检测MET扩增的比对情况:
-
对于仅FISH定点扩增的患者,组织NGS的敏感性88%,血液NGS仅达到43%,即使筛选那些血液样本中肿瘤突变丰度高于5%的高质量样本,敏感性也仅提升至64%;
-
对于FISH多倍体的患者,组织NGS敏感性仅4%,ctDNA的敏感性仅10%,即使EGFR+患者敏感性也只有30%;
-
对于所有样本来说,组织NGS、血液NGS或者高质量样本的血液NGS,敏感性都差强人意,仍需从技术水平优化提高。但NGS方法的特异性还是不错(即检出的阳性结果较为准确),在组织样本无法获取的情况下,血液NGS可以作为补充检测手段。

-
此外,适用于血检的高灵敏的数字PCR方法,也是潜在的MET扩增手段。
-
这项研究中,FISH定点扩增阳性的5个样本,全部被ddPCR检出,ddPCR还额外检出3例阳性(是否真阳性有待验证)。
-
FISH阴性的150个样本,147个被ddPCR识别为阴性,3个识别为阳性。
-
整体来看,两种检测方法的一致率达到98%,ddPCR在血检MET扩增方面具有较好的应用前景。

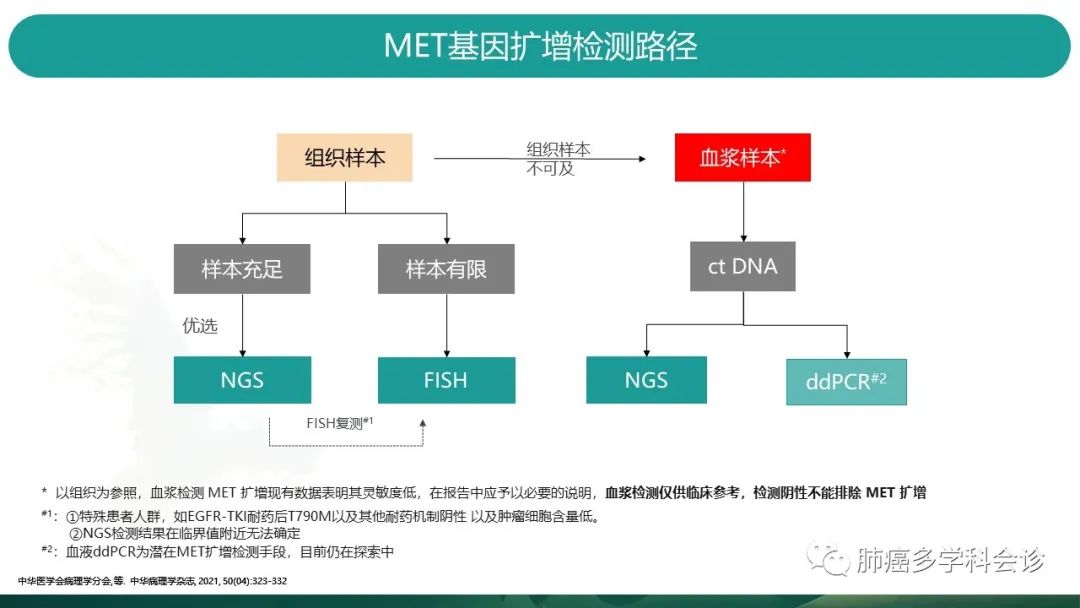
临床检测路径供参考:
-
当组织样本可及时,考虑到多基因检测需求,样本充足时可优选NGS(NGS显示MET阴性时,考虑到可能的假阴性,建议FISH复测);当样本量有限时,推荐FISH方法,所需样本量小,快速高效。
-
当仅能获取血液时,我们可选择NGS和ddPCR两种方法,但NGS对于血液样本中ctDNA的含量有较高要求,检测阴性时不能排除MET扩增。而ddPCR方法仍需扩大样本量进一步探索。

总结
-
MET通路参与NSCLC的发生及耐药进展, MET 14外显子跳跃突变和MET扩增均被指南推荐进行常规检测 -
基于DNA的NGS、基于RNA的NGS和RT-PCR均可用于MET 14外显子跳跃突变的检测并指导临床治疗 -
MET扩增的检测方法主要包括FISH、NGS和IHC,目前提示MET抑制剂临床获益的阈值在不同药物临床研究和不同检测方法中尚无定论,有待进一步明确
本篇文章来源于微信公众号: 肺癌多学科会诊