- A+
★
病例
★
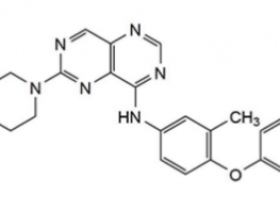
2016年12月,一名56岁不吸烟的白人男性因咳嗽、胸痛和呼吸困难入院,此前身体健康。多项检查,包括全身CT扫描和支气管纤维镜检查,诊断为右上叶肺腺癌,右肺门、脑、肝和骨有多个肿大淋巴结转移(T4N1M1c期,根据TNM第8版分类)。基于下一代测序(NGS),对原发性肿瘤进行EGFR检测,发现EGFR 21号外显子突变(c2573T>G,p.L858R),没有任何其他分子变异(图1和图2)。值得注意的是,鉴于免疫组化(IHC)显示MET过度表达,对其进行了基于MET DNP探针的FISH检测,结果显示7号染色体存在多倍体,但未发现MET扩增(MET/CEP7比值估计为0.5)。
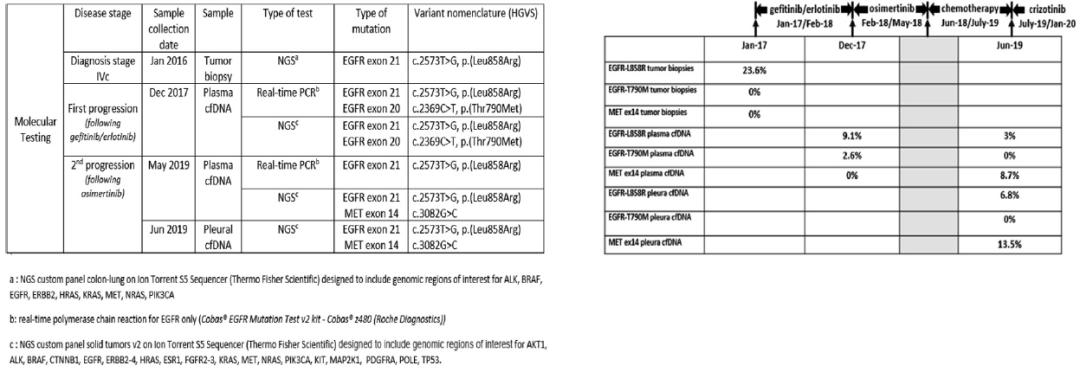
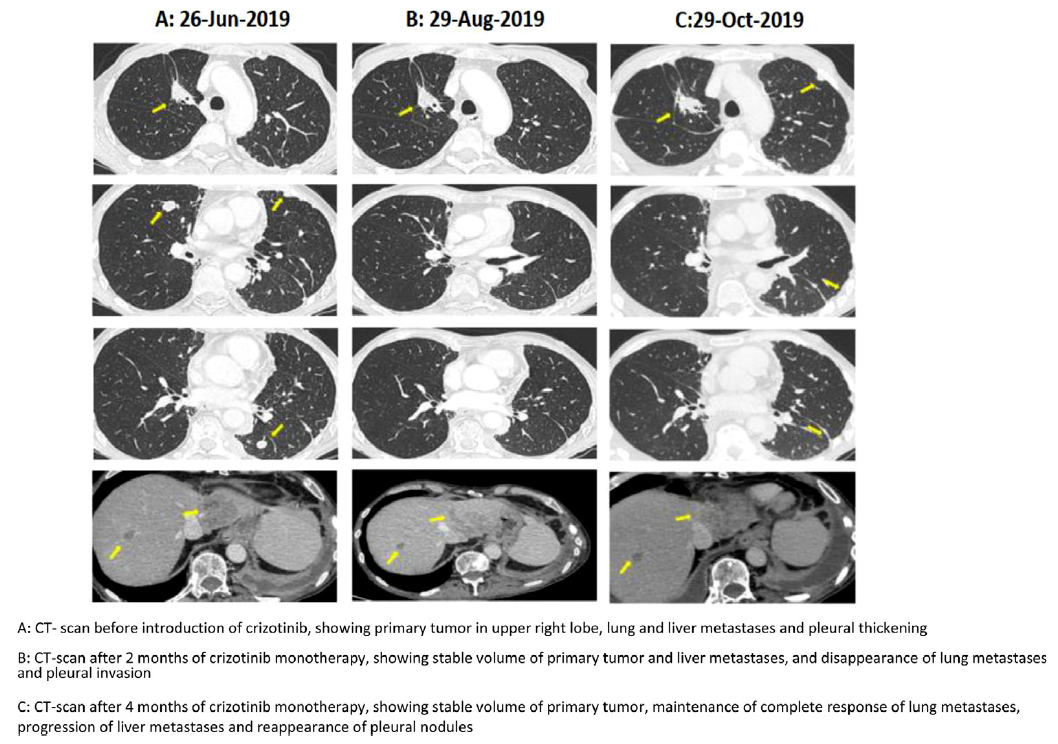
最初的治疗是对疼痛的骨区和脑转移进行姑息性放射治疗。随后,给予吉非替尼治疗时由于3级肝毒性迅速改用厄洛替尼。患者在12个月内取得了客观反应。2018年3月观察到原发肿瘤进展。使用RT-PCR对循环游离DNA(cfDNA)进行血浆活检单基因EGFR,发现了EGFR L858R突变和T790M突变。基于NGS对同一样本进行了事后分析,NGS panel涵盖了包括MET基因在内的20多个癌症相关基因,证实了EGFR L858R突变和T790M突变的存在,并没有发现其他基因变异(图1)。患者开始使用奥希替尼进行二线治疗。开始使用奥希替尼治疗5个月后,骨盆CT扫描发现髋骨进展,而原发性肺肿瘤已大幅减少。对骨转移瘤进行放疗,同时奥希替尼继续治疗。三个月后,再次CT扫描显示新的肝转移。患者随后接受培美曲塞联合卡铂化疗,病情稳定7个月,直到出现大量胸腔积液。对胸腔积液cfDNA的NGS分析确定了已知的L858R EGFR突变以及一个新的MET ex14跳跃突变c.3082G>c(图1)。基于NGS对血浆cfDNA进行分析,证实了这两种突变,但突变丰度低于胸腔积液。该患者接受了一个周期的挽救性化疗(贝伐单抗联合紫杉醇),但任何部位的病灶(肺和胸膜结节、肝和骨转移)均进展迅速。2019年7月,该患者服用了克唑替尼,其活性已在晚期MET ex14变异肺癌患者中报道。患者胸闷和气短症状迅速缓解,体重增加。6周后的后续CT扫描显示客观反应(图2),持续4个月。2019年11月,患者因ECOG体能状态下降、出现严重外周水肿和不明原因的嗜酸性粒细胞增多和肾功能衰竭而住院。患者于3天后因呼吸衰竭加重死亡。
讨论
本篇文章来源于微信公众号: 绘真医讯