癌症严重威胁人类健康,患者的5年整体生存率较低,其主要原因在于大部分癌症患者在确诊时已属中晚期。癌症的早筛早诊是提高患者生存率的关键;但目前癌症筛查方法存在操作复杂、可及性及依从性低等问题,并且很多癌症(如胰腺癌、卵巢癌等)尚未出现有效的筛查方式。
癌细胞在生长、坏死、凋亡的过程中,会释放一些癌症信号到体液(例如血液)中,通过检测体液中的癌症信号可以发现早期癌症。
随着液体活检技术的发展,癌症的早筛早诊也产生了诸多突破性进展。通过“一管血”进行早期癌症筛查,有望革命性地改变目前癌症筛查的困境,并显著改善患者生存率和社会经济负担。
图1:“一管血测多癌种:癌症早检新时代”一文获CELL Press旗下杂志发表
近日,复旦大学附属中山医院樊嘉院士团队、解放军总医院第二医学中心健康管理研究院主任曾强教授及国家癌症中心王洁教授团队与燃石医学合作的系统综述“circulating cell-free DNA for early detection of cancers”(基于cfDNA的液体活检在癌症早检中的进展)正式发表于CELL Press旗下杂志The Innovation。
该文章系统梳理了基于细胞游离DNA(cell free DNA,cfDNA)的液体活检技术在各癌种早期检测中的临床应用,并介绍了癌症早检生物标志物临床验证的关键阶段,让我们看到并可期待通过一管血即可进行早期癌症筛查的癌症诊疗新时代。
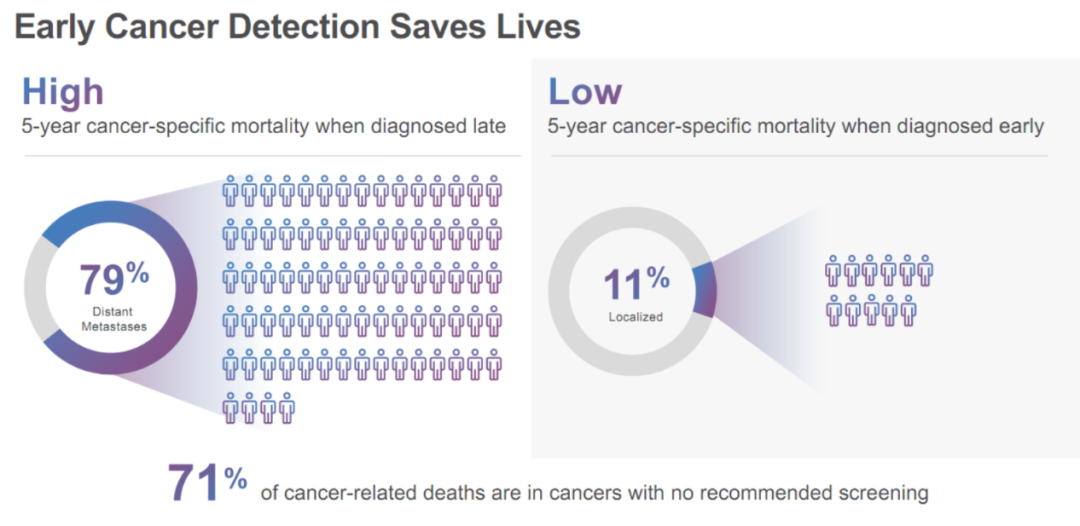
当下,癌症已是严重威胁人类健康的重大公共卫生问题。美国SEER数据库数据显示,诊断时已经转移的晚期癌症患者,5年死亡率高达79%,而未转移患者的5年死亡率为11%[1](图2),因此癌症的早筛早诊是提高患者生存率的关键。
另一个现实是:目前人类已知的癌症有五十余种,其中仅一小部分癌种具有权威机构推荐的有效筛查方法。这些为数不多筛查方法也并非“十全十美”,往往存在操作复杂、侵入性、可及性及依从性低等问题。而对于大部分无有效筛查方法的癌症来说,患者的处境则更为艰难,数据显示,尚未有推荐筛查方法的癌症患者占总体死亡率的71%[2](图3)。因此开发一种无创或微创、便捷、精准且适用于大规模人群的癌症筛查方法势在必行。
图3:美国预防医学工作组公布的美国50-79岁人群中,无推荐筛查方法的癌症新发比例占总体新发癌症的59.7%,死亡比例占癌症总体死亡率的71%
2020年,美国国家癌症研究所对癌症检测和诊断提出了新的方向:基于液体活检的癌症早检(Early Detection)。癌症早检包含了癌症筛查(Screening)和诊断(Diagnosis),目的是发现早期癌症,甚至癌前病变。
近年来,液体活检技术发展迅速,以其微创甚至无创的优势,以及在提示早期癌症及癌前病变患者方面表现出的良好潜力,为癌症筛查带来了新的“解题思路”。目前学界基于液体活检的单癌种早检或多癌种早检相关研究大部分聚焦于外周血中癌症相关生物标记物的检测,例如cfDNA、CTCS、mRNA、miRNA、蛋白质或代谢物等[3-4]。其中基于cfDNA的癌症早检是目前的主流研究方向,包括循环肿瘤DNA(Circulating Tumor DNA,ctDNA)突变、DNA片段化(Fragment)及DNA甲基化 (Methylation)。
与DNA甲基化检测方法相比,前两者有一定的自身局限性。针对ctDNA突变的检测方法往往需要通过超高的测序深度来提高检测的敏感性,但这也带来了假阳性、检测成本过高等问题,同时还需考虑克隆性造血带来的影响。针对ctDNA突变的检测所能覆盖的位点有限,且无法实现组织溯源,仅在特定癌种中有较高的应用价值,如有近80%患者具有KRAS突变的胰腺癌,可以通过检测KRAS等热点基因进行早检。
肺癌、肠癌、肝癌、肾癌是早检研究覆盖较多的癌种,针对ctDNA突变的检测方法在这些癌种中的应用价值表现不一。对于cfDNA含量较低且信号不够丰富的早期癌症,如肺腺癌和肾癌,针对ctDNA突变的检测方法的早检敏感性较低;而肝癌因自身释放的cfDNA在血液中有较高含量,表现出较高的敏感性。
而基于DNA片段化检测方法的主流测序手段是低深度全基因组测序,由于测序深度低、检测成本高及信号强度低等因素,限制了其检测的敏感性及在临床中的应用。
基于此,由于甲基化改变在癌症发生的早期阶段就会出现,检测位点相较于突变更加丰富,信号强度较高且具有组织特异性,在多癌症早检中表现出较为理想的性能,成为了早检研究目前的热点。
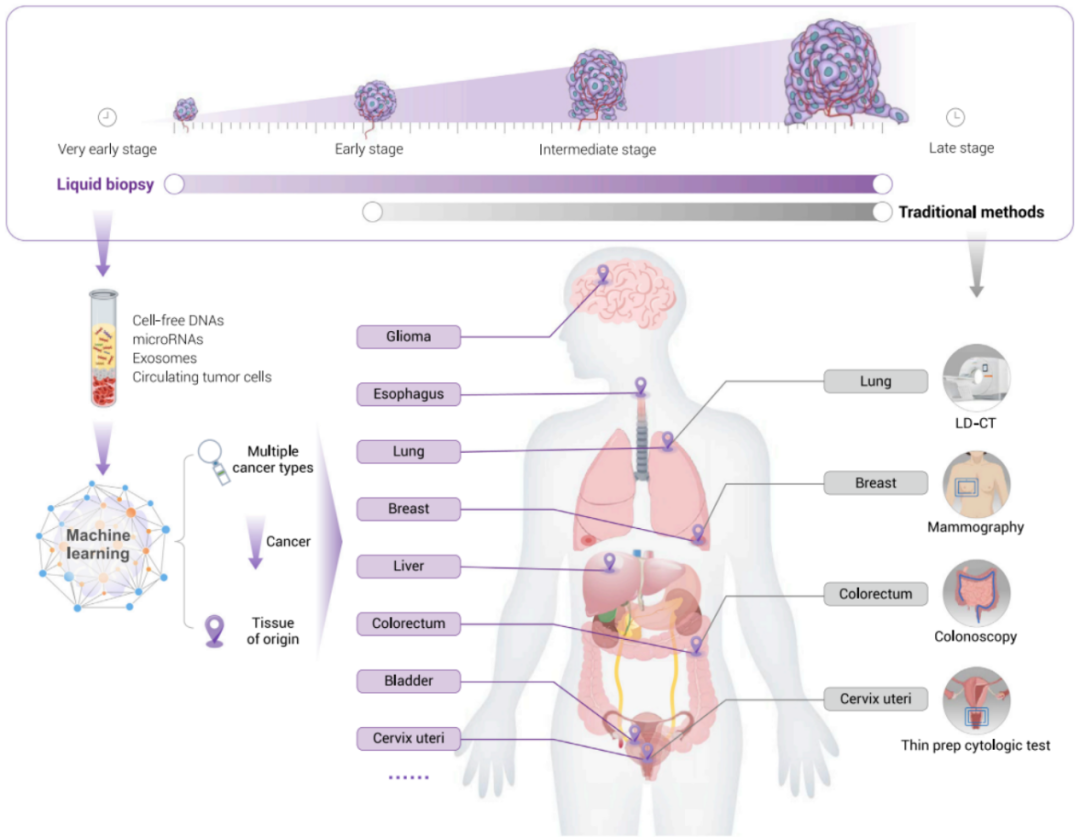
同时,相较于单癌种早检,基于cfDNA甲基化的多癌种早检技术在通过一管血同时检测多种癌症的同时,可以实现准确的组织溯源,被认为是癌症早检领域的技术突破口(图4)。
图4:基于外周血的液体活检癌症早检技术可检测到早期癌症并能实现准确组织溯源
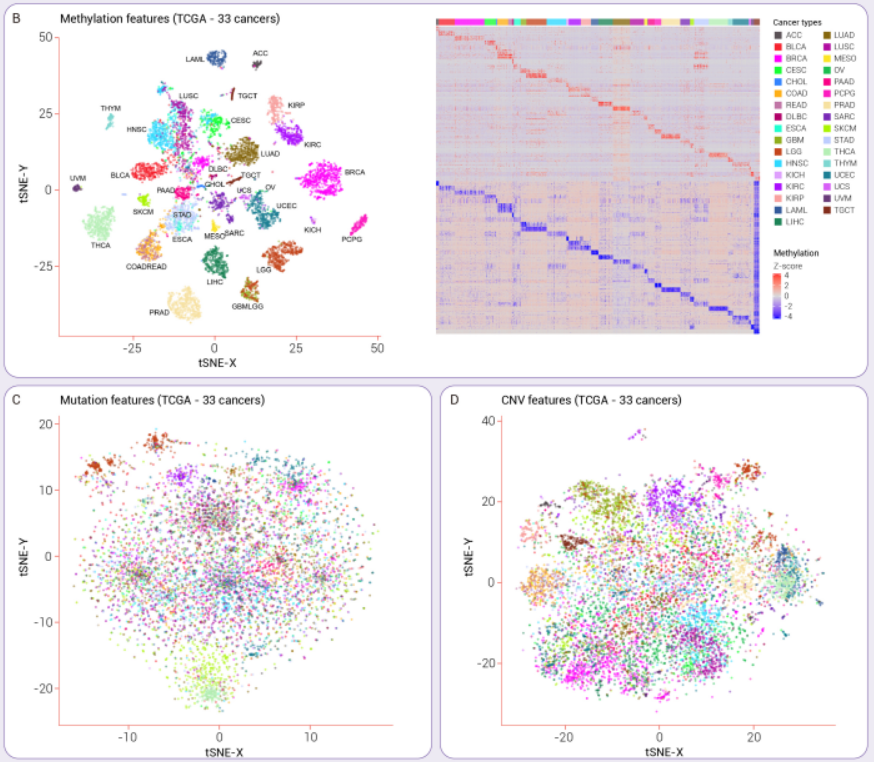
通过对TCGA 33个癌症基因组学的分析可以看到,DNA甲基化具有较高的组织特异性,相比基因拷贝数变异和突变具有更为准确的组织溯源能力(图5)。
图5:基于DNA甲基化特征的癌症组织溯源能力显著优于拷贝数变异及突变特征
基于cfDNA甲基化靶向测序技术在多癌种早检中的研究进展
经过前期探索,基于cfDNA甲基化靶向测序技术的性能在中国人群中得到初步验证。
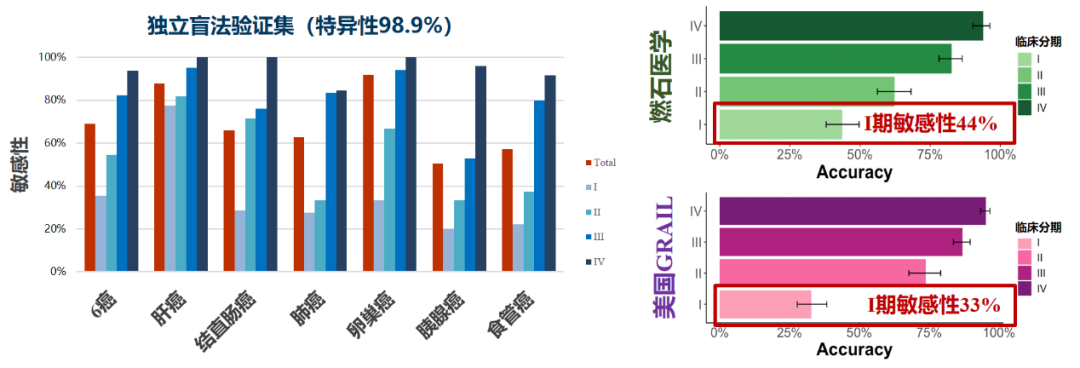
由上海复旦大学附属中山医院樊嘉院士、高强教授团队与燃石医学合作的中国首个前瞻性、盲法、独立验证研究(THUNDER),在肺癌、肠癌、肝癌、卵巢癌、胰腺癌和食管癌6大癌种中达到98.9%的特异性和69.1%的敏感性以及83.2%的组织溯源准确性[5]。
图6:首个中国前瞻性、盲法、独立验证的液体活检多癌种早检研究数据公布,性能媲美Grail
目前,多癌种筛查尚未有临床有效性、效益风险和临床使用的标准,为了给癌症早检临床发展提供一个总体视角,文章介绍了新型诊断生物标志物(基于 cfDNA 的液体活检)在获得法规批准之前应考虑的三大关键临床阶段:
1)检测方法的开发和验证,包括病例对照队列中的分析验证和临床验证;
2)在预期用途人群中进行的小样本前瞻性可行性研究,涉及敏感性、特异性、阳性预测值(PPV)和阴性预测值(NPV);
3)针对预期用途人群的大样本前瞻性关键研究,具有大样本量,以评估疗效、安全性和最终的成本效益。
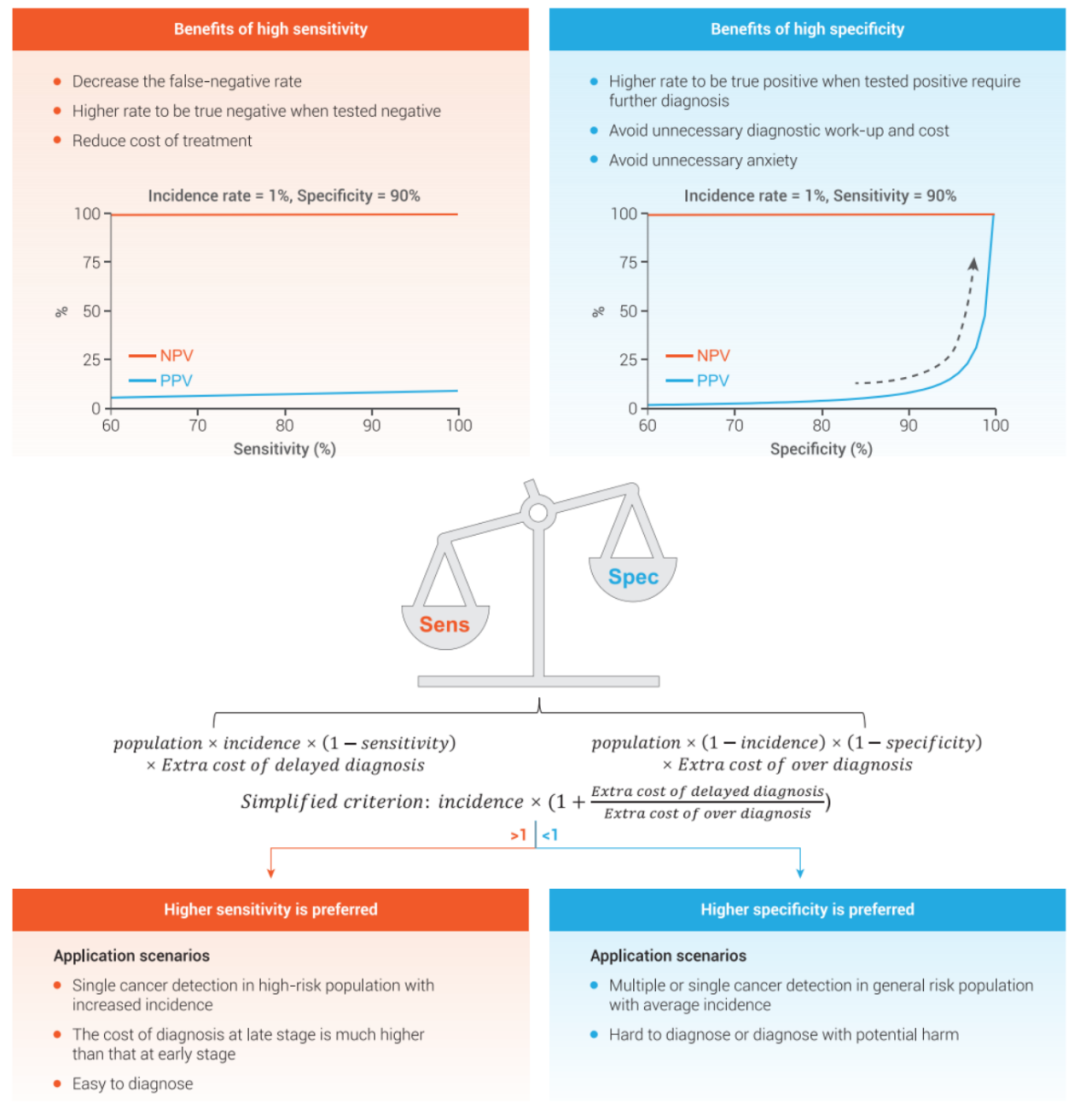
其中,敏感性和特异性往往是开发过程中需要平衡的天平两端。比如,在无症状的平均风险的群体中,高特异性对多癌种筛查非常重要,否则,相当数量的健康个体将被诊断为假阳性,造成不必要的后续诊断和焦虑情绪;另一方面,对于具有特定高风险因素的人群,高敏感性则特别重要,否则会造成一定程度的漏检。因此从社会经济学的角度,如何权衡两者显得至关重要。
图7:基于cfDNA的液体活检癌症早检技术的敏感性和特异性“天平”
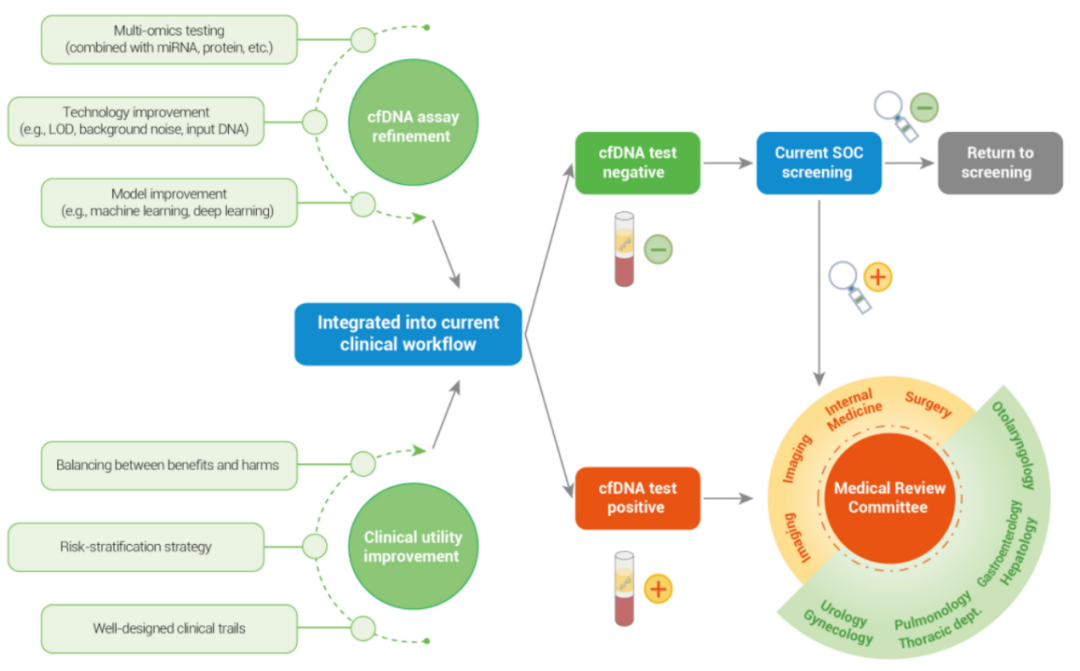
目前,燃石医学先后启动了中国超万人、前瞻性多癌种早检临床试验项目PREDICT(Pan-canceR Early DetectIon projeCT),基于液体活检多组学的前瞻性泛癌种早检万人研究PRESCIENT(Pan-canceR Early-Stage deteCtion by lIquid biopsy tEchNique projecT),及针对无症状人群的前瞻干预性万人研究PREVENT(A Prospective multi-canceR Early-detection and interVENTion study),以期推动中国多癌种早检产品的临床验证和开发。
图8:基于cfDNA的液体活检癌症早检技术的应用及临床路径建立
随着基于液体活检的多癌种早检技术日趋成熟并进入临床应用,癌症的诊疗路径也将发生改变,基于液体活检的早检技术将作为传统癌症筛查方法的重要补充[图8],为更多癌症尤其是无推荐筛查方法的癌症提供筛查选择,以期把更多的癌症拦截在早期,从而改善癌症患者生存率,减轻社会经济负担。
-
高特异度,避免过度诊断,减少受检者不必要的精神焦虑和随访负担;
-
-
组织溯源,准确预测肿瘤部位,精准指导后续的临床检查;
-
高性价比,使早检的成本可以控制,便于大范围推广使用;
-
侵入性小,便于操作,从而能够提高民众筛查的依从性。
随着液体活检技术的发展,相信在不久的将来,多癌种早检技术将真正开启癌症诊疗新时代。
【作者简介】
樊嘉,中国科学院院士、复旦大学附属中山医院院长,享受国务院特殊津贴专家、博士生导师、教授、主任医师。上海市肝病研究所所长、上海市肝脏肿瘤临床医学中心主任,复旦大学肝癌研究所所长、复旦中山肿瘤防治中心主任。中国医师协会外科医师分会会长,中国医师协会外科医师分会肝脏外科医师委员会主任委员,CSCO副理事长、中华医学会常务理事、FACS、ASCO、SSO,《原发性肝癌诊疗规范/指南(2017年版、2019年版、2022年版)》编写专家委员会主委。
-
Noone AM, Howlader N, Krapcho M, Miller D, Brest A, Yu M, Ruhl J, Tatalovich Z, Mariotto A, Lewis DR, Chen HS, Feuer EJ, Cronin KA (eds). SEER Cancer Statistics Review, 1975-2015, National Cancer Institute. Bethesda, MD, https://seer.cancer.gov/csr/1975_2015/, based on November 2017 SEER data submission, posted to the SEER web site, April 2018.
-
Glenn D Braunstein, Joshua J Ofman. Criteria for Evaluating Multi-cancer Early Detection Tests. touchREVIEWS in Oncology & Haematology. https://doi.org/10.17925/OHR.2021.17.1.3
-
Pantel, K., and Alix-Panabières, C. (2019). Liquid biopsy and minimal residual disease - latest advances and implications for cure. Nature Reviews Clinical Oncology 16, 409-424.
-
Ellen, Heitzer, Imran, et al. (2018). Current and future perspectives o 不能f liquid biopsies in genomics-driven oncology. Nature Reviews Genetics 20, 71-88.
-
2022 ASCO Annual Meeting poster #420
本篇文章来源于微信公众号: 医世象