- A+
TMB,全称是tumor mutational burden,简称TMB,翻译成中文就是:肿瘤突变负荷。TMB是最近三四年来,伴随着肿瘤免疫治疗兴起而火起来的一项重要的分子标志物。前期研究显示,该指标可以预测PD-1疗效,而且是截至目前已经发现的单个指标里,属于预测免疫治疗疗效功能最强大的第一梯队。
除此之外,近期的诸多研究显示:TMB的高低,不仅可以预测免疫治疗的疗效,而且可以精准预测不少靶向药和化疗药的疗效。今天就给大家全面科普一下TMB在肿瘤精准治疗中的作用。
1
TMB预测PD-1的疗效
相关研究众多,已写入指南
关于TMB用于预测PD-1抗体、PD-L1抗体、CTLA-4抗体等免疫治疗的疗效,已经有众多研究。咚咚肿瘤科也已经做过不少的科普,这里重点向大家推荐2篇旧的科普文章,欢迎大家温故而知新:
- 精准预测免疫治疗效果:TMB彻底火了!
- 10万病例:深度解析TMB,PD1与长期生存
以上两篇科普文章,都是2017年底写作的,基本上涵盖了当时对TMB与免疫治疗相关性和预测能力的全面介绍。2018年,随着PD-1抗体联合伊匹木单抗用于TMB>10个突变/Mb的晚期非小细胞肺癌一线治疗,三期临床试验的巨大成功,TMB检测第一次名正言顺、理直气壮地被写入了NCCN指南。多个临床数据提示:TMB越高,使用PD-1治疗有效的可能性越大;反之亦然。因此,不少基因检测公司也会给患者进行TMB检测,以此预测PD-1抗体的疗效。
不过,TMB除了跟PD-1有效率有关,是否还跟患者的生存期有关?毕竟,对于癌症患者来说,活得久才是硬道理。一直以来,学术界都在等这项重磅研究:TMB高低与患者总生存期的相关性,尤其是跨癌种,大样本量。
2019年2月,这项研究结果终于出炉,发表在《Nature Genetics》(医学遗传学研究最顶尖杂志)上。这项大气磅礴的研究,分析了1662名接受过PD-1抗体等免疫治疗的癌症患者的TMB数据以及5371名未接受过免疫治疗的癌症患者的TMB数据,同时随访了每一位患者的生存数据。通过深入分析和对比,研究小组发现:如果把每个癌种里TMB最高的10%或者20%的病人,定义为TMB高的人群;余下的人群,定于为TMB低的人群。那么,几乎对于所有肿瘤,高TMB人群的总生存期明显长于TMB低的人群,中位总生存时间能相差40%。
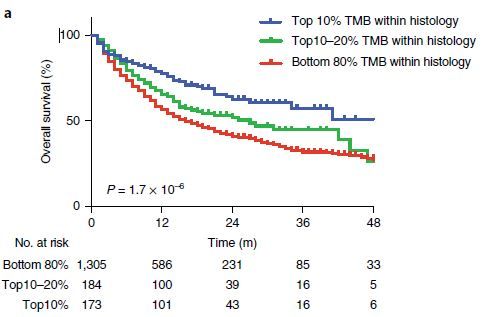
这项研究再一次证实了:用TMB高低来筛选人群,TMB高的患者,接受免疫治疗不仅短期疗效好(有效率高、无疾病进展生存期长),而且长期的总生存期也明显延长。
2
TMB预测靶向药疗效
方兴未艾、精彩纷呈
TMB高低不仅可以预测免疫治疗的疗效,近期的研究表明:它还可以预测靶向治疗的疗效。
2019年2月,《Clinical Cancer Research》杂志发布了一项由美国排名并列第一的癌症医院——纽约斯隆-凯特琳癌症中心,Hellmann MD教授主导的研究成果。他们分析了153名EGFR突变的、接受靶向药治疗的晚期肺癌患者,检测了TMB,同时观察了靶向药的疗效。他们发现,相比于另外1849名EGFR野生型患者,EGFR突变的患者TMB是低的;平均数分别是3.77和6.12。跟免疫治疗不同,在EGFR突变的病人里,TMB较高的患者,接受靶向治疗,疗效维持时间较短、中位总生存时间较短。
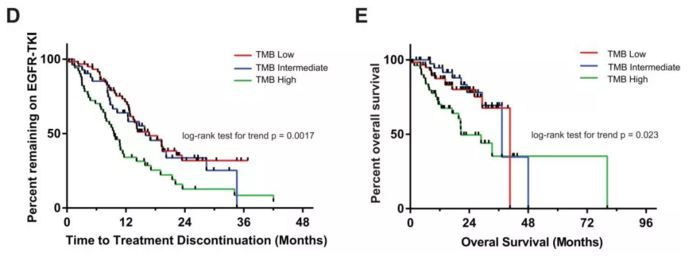
无独有偶,2019年3月,《JCO》杂志公布了一项TMB与肠癌靶向治疗相关性的研究。这项研究采用的是国际著名的CALGB/SWOG 80405三期临床试验的数据,这项入组了843名晚期肠癌的国际多中心临床试验,对比贝伐联合化疗与爱必妥联合化疗作为晚期肠癌一线治疗的经典临床试验,具有划时代的意义。从这个临床试验后续的诸多分析中,产生了无数治疗肠癌的智慧和理念。
这一次,专家们心血来潮,又把入组患者的TMB检测了一下,然后与患者接受不同靶向药治疗的疗效、生存期数据进行了深入分析,他们发现:TMB高的病人,相比于TMB低的病人,总生存时间平均延长27%。而且,他们还发现一个重要的、出人意料的结果:在TMB高的人群中,贝伐联合化疗,相比于爱必妥联合化疗,疗效明显更好,生存期明显更长——贝伐联合化疗,相比于爱必妥联合化疗,疾病进展的风险下降87%。
3
TMB预测化疗:TMB高的早期肺癌
或许可以免于辅助化疗
在II期肠癌里,TMB高(也就是MSI阳性)的患者,目前国内外的专家学者已经基本公认:这类患者,大概率可以免于辅助化疗。针对这类患者的术后巩固性化疗,并不能延长生存期,因为这类患者本身的复发风险就已经很低、生存期本来就已经很长。
同理,近期的一项在肺癌中开展的类似研究,也得出了相似的结果。2018年8月,发表在JCO上的一项入组了1608名早期肺癌患者的研究,对其中1008名患者进行了TMB检测。其中:453例仅接受手术切除的患者、455例接受手术切除加辅助化疗。908名最终检测顺利完成,有TMB数值的病人,根据TMB的高低可以分成3类:TMB≤4个突变/Mb、4<TMB≤8个突变/Mb、TMB>8个突变/Mb——一如既往,TMB高的患者,生存期更长,TMB低的患者生存期更短。
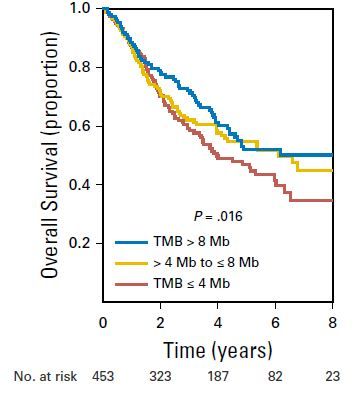
此外,该研究还发现:在TMB较高的患者中,手术后是否接受辅助化疗,不影响生存期;在TMB较低的患者中,手术后加做辅助化疗,明显延长生存期——因此,该研究小组提出:对于手术切除的早期肺癌患者,先检测TMB,TMB高的患者不用做化疗,TMB低的患者,才需要做化疗。从下图可以看出来:在TMB<4的肺癌人群中,术后化疗明显延长生存期,两条曲线明显分开(E图);而在TMB>8的肺癌病人中,术后化疗不能延长生存期,两条曲线几乎重合,也就是这类人群化疗打了白打(G图)。
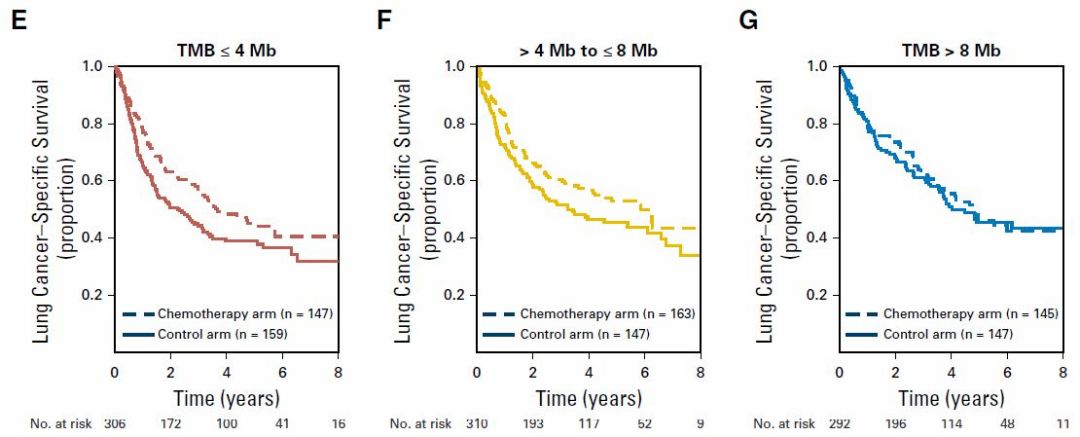
所以,TMB对于免疫、靶向和化疗都有一定的临床意义。简单总结一下就是:
- TMB越高,PD-1等免疫治疗的有效率越高,生存期越长;
- EGFR突变的肺癌患者,TMB越高,反而靶向治疗效果越差;
- TMB高的晚期肠癌患者一线治疗,贝伐+化疗疗效更好;
- 对手术切除的早期肺癌患者来说,TMB越高,生存期越长,术后辅助化疗或可避免。
注意:由于临床样本有限,本文仅供专业人士解读!
参考文献
1. Tumor mutational load predicts survival afterimmunotherapy across multiple cancer types.Nat Genet. 2019 Feb;51(2):202-206.
2. Tumor Mutation Burden and Efficacy ofEGFR-Tyrosine Kinase Inhibitors in Patients with EGFR-Mutant Lung Cancers.Clin CancerRes. 2019 Feb 1;25(3):1063-1069
3. Mutational Analysis of Patients With ColorectalCancer in CALGB/SWOG 80405 Identifies New Roles of Microsatellite Instabilityand Tumor Mutational Burden for Patient Outcome.J Clin Oncol. 2019 Mar 13:JCO1801798
4. Tumor Mutation Burden as a Biomarker in ResectedNon-Small-Cell Lung Cancer.J Clin Oncol. 2018 Aug 14:JCO2018781963
5. Correlation of PD-L1 Expression with TumorMutation Burden and Gene Signatures for Prognosis in Early-Stage Squamous CellLung Carcinoma.J Thorac Oncol. 2019 Jan;14(1):25-36.