- A+
今天与大家分享:MET基因拷贝数增加(Copy Number Gain,CNG)在初治EGFR突变NSCLC患者中的临床意义。


MET基因拷贝数增加,
是MET基因扩增吗?
CNV gain = Amplification?
它们都能导致EGFR-TKI耐药吗?
为什么标题说:
MET扩增才是导致EGFR-TKI耐药的决定因素,
而不是说,
MET拷贝数增加才是导致EGFR-TKI耐药的决定因素?
MET基因拷贝数的增加可以称为 MET-High或者MET CNV gain(CNG,定义为每个细胞核中MET基因拷贝数≥5),它主要有两种形式:一种是 Polysomy(多染色体,CNV≥5且MET/CEP7<2.0),另一种是 Amplification(扩增,CNV≥5且MET/CEP7≥2.0)。所以不能直接的认为MET拷贝数增加就是MET扩增!
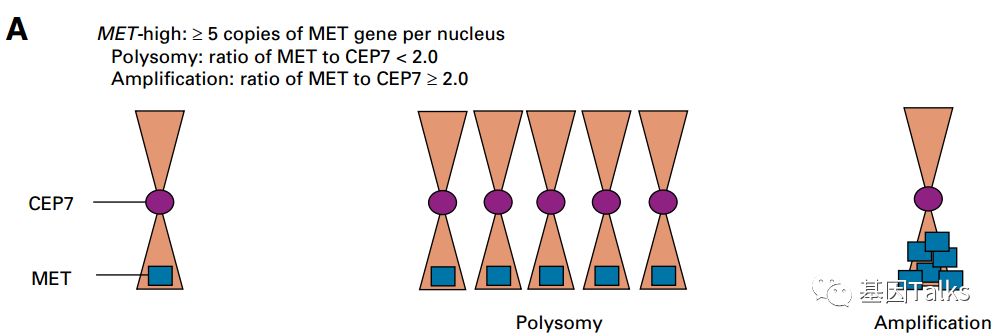
▲ MET拷贝数增加的两种形式
MET多染色体导致的MET基因拷贝数增加并不会影响EGFR-TKI的活性,MET基因扩增导致的MET基因拷贝数增加则会导致EGFR-TKI的耐药,所以,MET扩增才是导致NSCLC患者EGFR-TKI耐药的决定因素!(NGS检测MET扩增通常会漏检MET多染色体的情况3)
简而言之,就是MET基因拷贝数增加不能直接说明EGFR-TKI耐药,MET的基因扩增才是导致EGFR-TKI耐药的真正原因!
EGFR-TKI(酪氨酸激酶抑制剂)已被广泛用于治疗EGFR突变的NSCLC患者,但是很多患者在使用 EGFR-TKI 后会出现耐药情况。研究表明,MET基因扩增是导致EGFR-TKIs耐药的主要原因之一,MET扩增通过激活ERBB3(HER3)—— 依赖性激活PI3K,EGFR/ERBB家族受体的特异性通路。
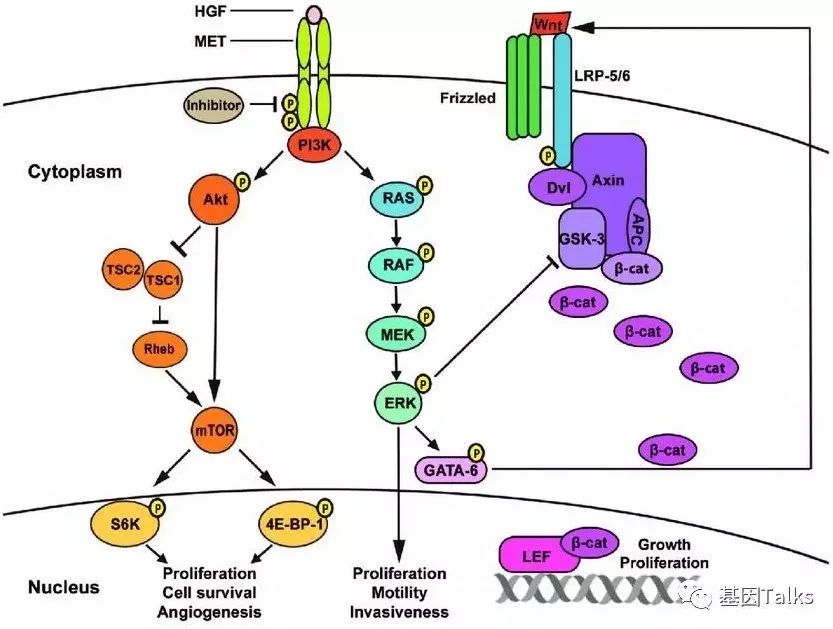
▲ c-MET通路激活可导致EGFR抑制剂耐药
MET,Mesenchymal epithelial transition factor,即间质上皮细胞转化因子,位于7号染色体,包括21个外显子和20个内含子,是一种多功能的跨膜酪氨酸激酶,是肝细胞生长因子HGF的受体,主要在上皮细胞中表达。

▲ MET基因及其信号通路
c-MET受体与HGF结合后,在酪氨酸激酶结构域的Y1234和Y1235酪氨酸残基上磷酸化,诱导激酶活性,同时,C末端Y1349和Y1356磷酸化建立多功能对接位点招募有SRC同源区2(SH2)结构域的信号分子,然后激活这些信号分子导致下游信号激活传导。最终结果是促进细胞转化,细胞侵袭,细胞增殖,细胞周期进展等等。
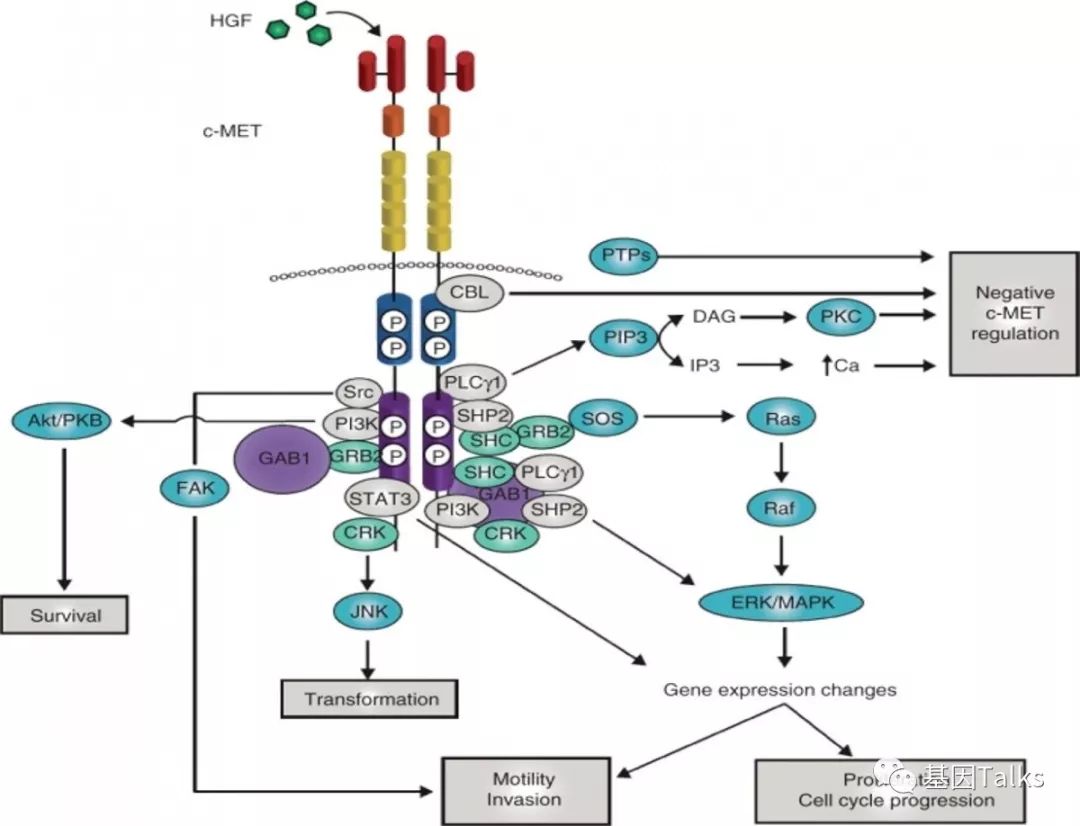
▲ MET通路激活机制
外显子14的剪接变异会导致外显子14的跳跃进而导致近膜结构域被破坏,泛素化降解酶c-CBL结合位点缺失,c-MET信号延长。MET-TKI结合催化结构域磷酸化位点,抑制 Y1230/Y1234/Y1235 磷酸化,从而抑制 Y1349/Y1356 附着点磷酸化,抑制下游信号分子招募。
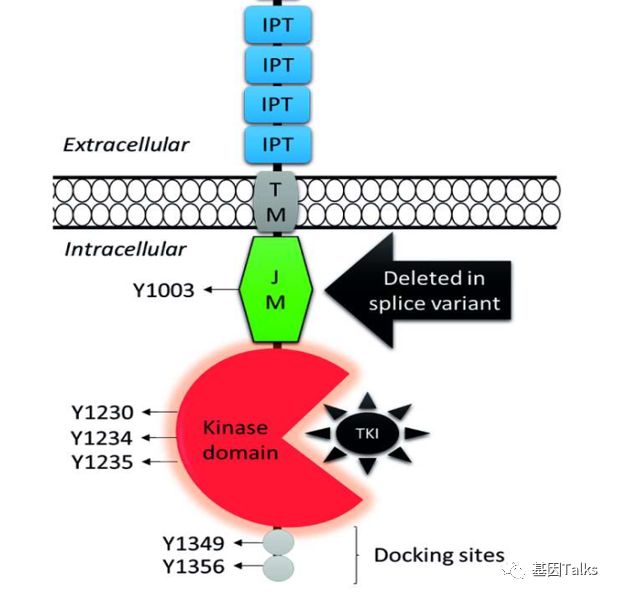
▲ MET exon14 skipping与MET-TKI
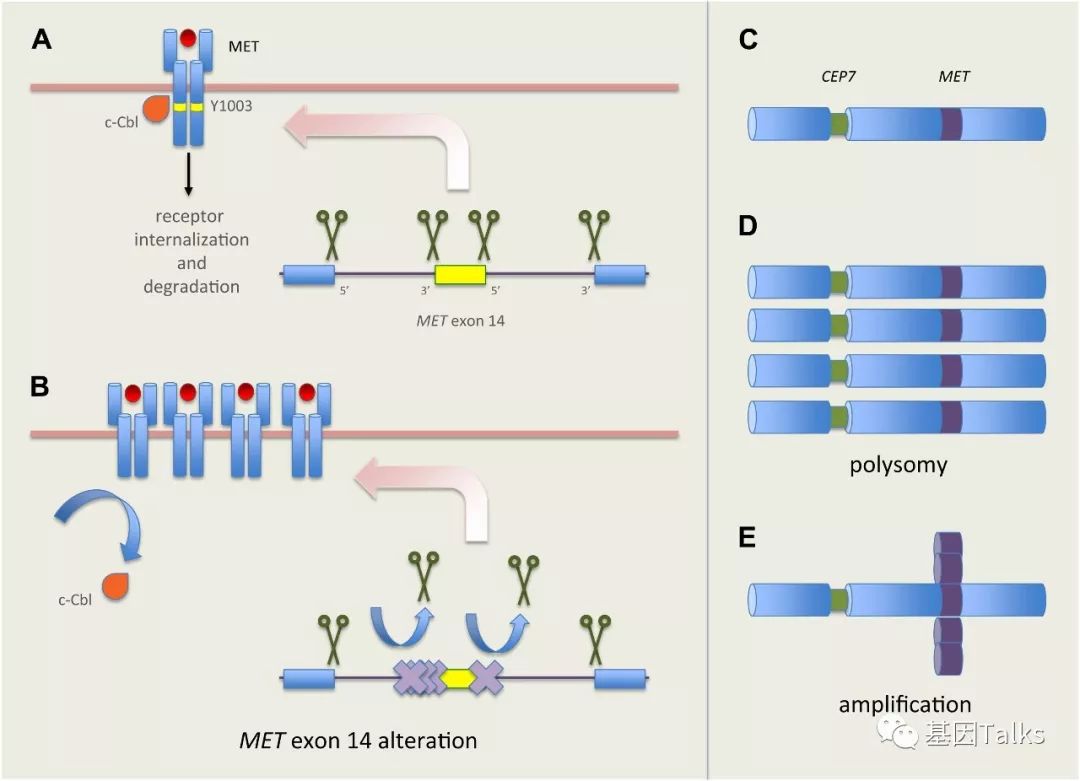
▲ MET exon14跳跃和CNG是主要的致癌驱动因素
今天我们不说MET点突变,我们重点说说MET的拷贝数增加,MET的基因扩增及它们与EGFR-TKI的耐药关系。
MET基因比较复杂,MET CNG与其他占主导地位的致癌基因不同(一般一个癌细胞只会出现一个占主导地位的致癌基因突变,不会出现两个,即致癌基因互斥),MET CNG经常与其他致癌驱动因子共存,例如EGFR、ALK和KRAS2。EGFR突变的NSCLC患者使用EGFR-TKI产生原发性耐药就是这个原因。
一、研究思路:
研究共入组了两个队列的人群。第一队列包括200例EGFR突变的NSCLC患者;第二队列包括13例早期EGFR突变的NSCLC的患者,共取59处组织区域,用于外显子测序和SNP列阵测序,以确定MET CNG的状态,探讨MET CNG的肿瘤内异质性。分析154例(39+115例)使用EGFR-TKI单药治疗患者的临床结果与MET状态的相关性。研究的主要终点是TTF,即从开始使用EGFR-TKI到停止使用EGFR-TKI(包括疾病进展、不可接受的毒理反应、患者要求停药)。TTF小于6个月定义为EGFR TKI原发耐药。
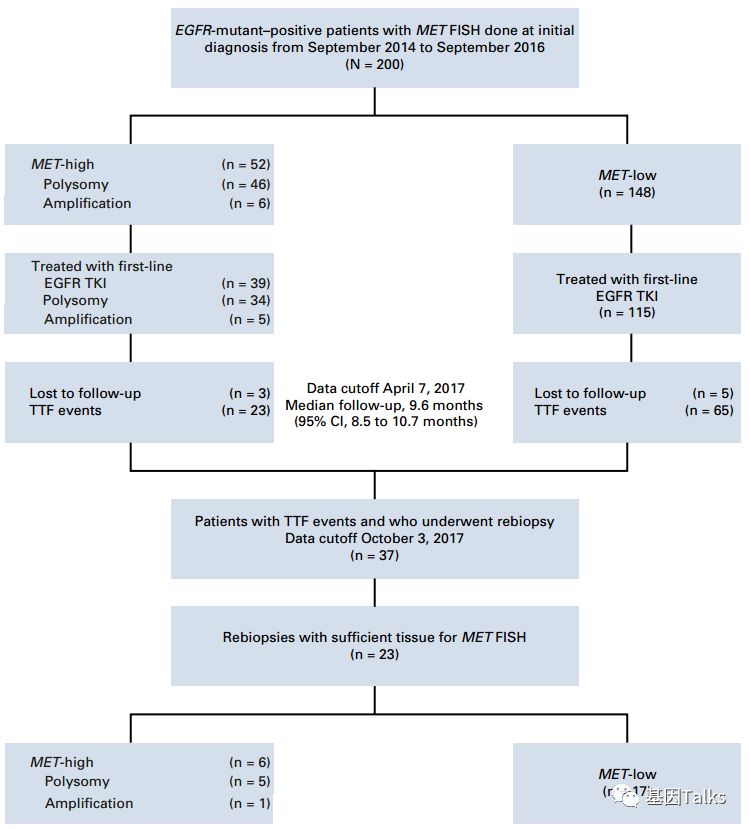
▲ 本研究研究思路
二、研究方法:
1,MET扩增检测:使用雅培的探针进行FISH检测,检测200个EGFR突变的转移性NSCLC患者中MET基因扩增情况。MET基因扩增定义为:MET基因拷贝数≥5 且 MET/EP7比值≥2.;
2,EGFR突变检测:sanger测序或罗氏cobas法。
三、研究结论:
200例EGFR突变的NSCLC患者中52例(26%)检测结果为MET-high(或CNG),其中46例(23%)为多染色体,6例(3%)为扩增,这与以往报道的原发MET扩增发生率1~5%一致。
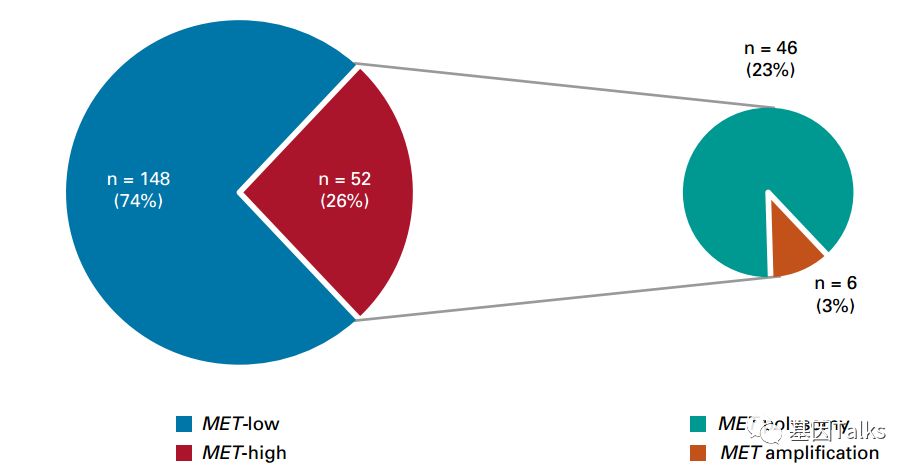
▲ 200例NSCLC患者的MET CNG比例分布情况
MET-high和MET-low的TTF分别为12.2个月、13.1个月,表明MET CNG的状态并未显著的影响EGFR-TKI的药效(下图A),但是在MET扩增的 5 个接受EGFR-TKI治疗的病人中,显示不良预后,表示MET扩增才是导致EGFR-TKI耐药的决定因素(下图B)。6个MET-high的患者中,3个在治疗后MET缺失,这可能与肿瘤异质性有关。
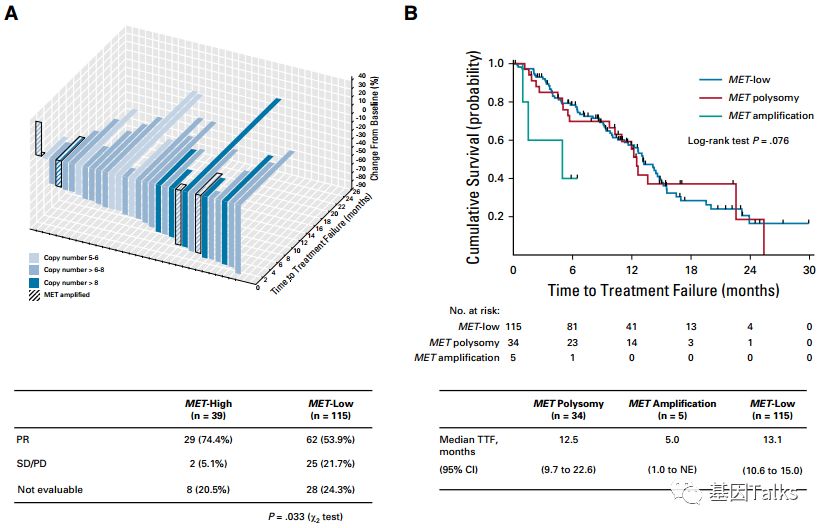
▲ MET-high和MET-low的TTF情况
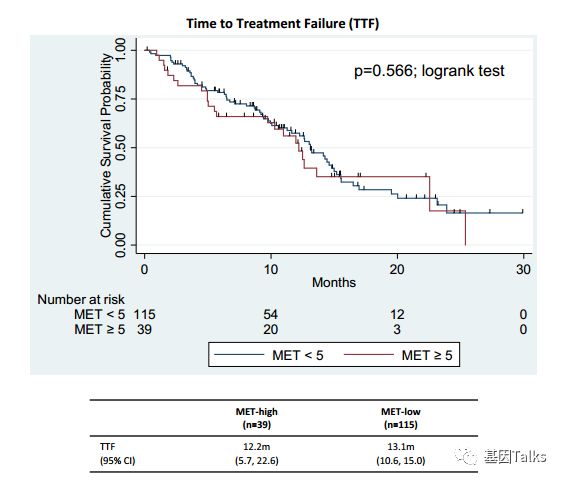
▲ 转移性EGFR M+ NSCLC患者治疗失败的时间是相似的,无论MET是high还是low。
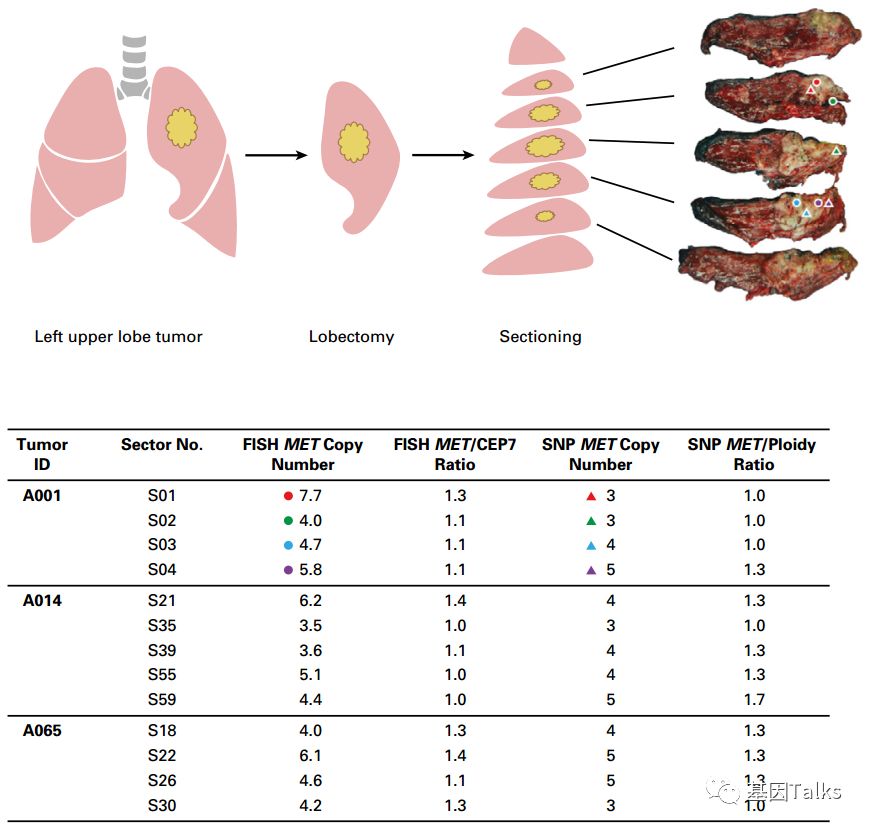
▲ 三例样本肿瘤异质性的研究

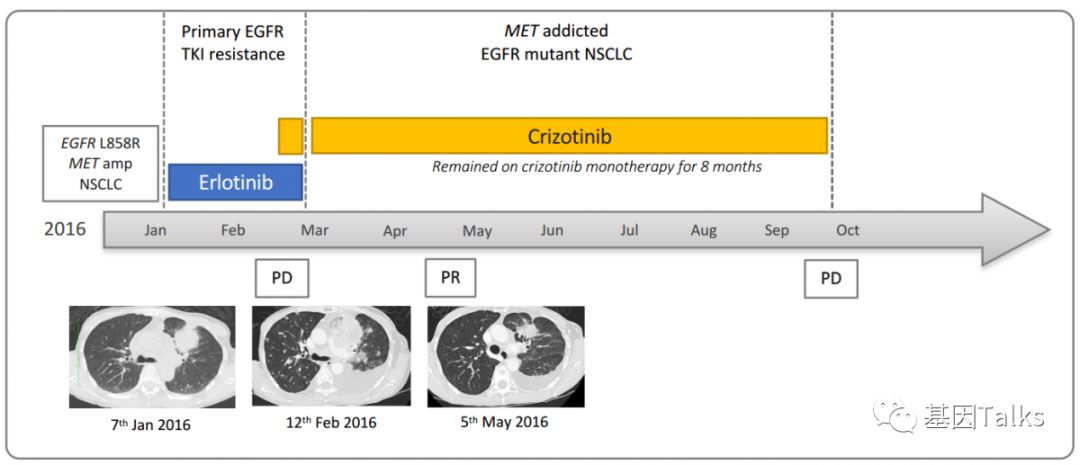
本文案例分享:MET扩增才是NSCLC患者EGFR-TKI耐药的决定因素!
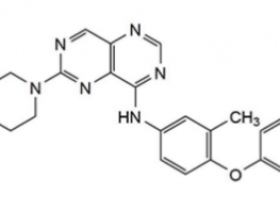
该患者为62岁不吸烟女性,EGFR L858R突变,并发MET扩增(拷贝数7.3;MET/CEP7为3.4;ROS1/ALK阴性),在使用一代EGFR-TKI 厄洛替尼治疗4周后出现疾病进展,这时候联合克唑替尼进行联合治疗(目前批准上市的用于治疗MET扩增或exon14 skipping 的药物仅有克唑替尼,卡博替尼)。
治疗几天后,患者由于无法耐受厄洛替尼与克唑替尼的联合治疗,便每隔一天接受克唑替尼单药治疗,出乎意料的是,她的肺部病变显著消退,我们可以认为这可能是MET扩增驱动占主导的EGFR突变NSCLC,也是MET扩增导致EGFR-TKI耐药的真正原因。
相关阅读:
2019 AACR丨沃利替尼针对MET扩增导致EGFR-TKI耐药后的治疗新策略!
【CSCO卫星会笔记】C-MET抑制剂沃利替尼在非小细胞肺癌的研究进展
参考资料:
1.Lai G G Y, Lim T H, Lim J, et al. Clonal MET Amplification as a Determinant of Tyrosine Kinase Inhibitor Resistance in Epidermal Growth Factor Receptor–Mutant Non–Small-Cell Lung Cancer[J]. Journal of Clinical Oncology, 2019: JCO. 18.00177.
2.Noonan SA, Berry L, Lu X, et al: Identifying the appropriate FISH criteria for defining MET copy number-driven lung adenocarcinoma through oncogene overlap analysis. J Thorac Oncol 11:1293-1304, 2016
3.Detection of MET-mediated EGFR tyrosine kinase inhibitor (TKI) resistance in advanced non-small cell lung cancer (NSCLC): biomarker analysis of the TATTON study. 2019 AACR