- A+
意大利和新加坡的癌症科学研究团队的R.Kumar和B.Somalanka等人的一项最新研究发现:一种常用于治疗绦虫感染的药物可以靶向治疗p53突变肿瘤。由于超过一半的癌症病人肿瘤中的抑癌基因p53存在突变,这使得p53成为了一个极具吸引力的抗癌靶点。基于他们的发现,研究人员已经为这项研究申请了专利。由于这种药物是靶向p53缺陷,而非靶向特殊的基因突变,因此它将适用于更大范围的p53突变的肿瘤。氯硝柳胺已经在人体身上使用了数十年,被WHO列为一种有效、安全而便宜的药物,这使得氯硝柳胺可能成为一种真正的可以治疗一系列p53缺陷的肿瘤的靶向广谱抗癌神药。
科学家的这项伟大发现可以说是惊艳了世界,让广大普通癌症患者看见了曙光。此项科学研究报告“Mitochondrial uncoupling reveals a novel therapeuticopportunity for p53-defective cancers”于2018年9月26日发表在著名的国际科学期刊《Nature》子刊《Nature Communications》上。

P53(TP53)基因是人类各种癌症中最常出现突变的抑癌基因。
p53基因是人体一种肿瘤抑制基因(tumor suppressor gene),位于17号染色体p13,全长16-20kb,含有11个外显子,转录2.8kb的mRNA,编码一种分子量为43.7KDa的P53蛋白质,是一种核内磷酸化蛋白。因蛋白条带出现在Marker所示53KDa处,命名为P53。p53基因的失活对肿瘤形成起重要作用。mdm2突变 与 P53突变不共存,p53是一个重要的抗癌基因,其野生型使癌细胞凋亡,从而防止癌变。P53还具有帮助细胞基因修复缺陷的功能。p53是迄今为止发现的与人类肿瘤相关性最高的基因。过去一直把它当成一种癌基因,直至1989年才知道起癌基因作用的是突变的p53,后来证实野生型p53是一种抑癌基因。
野生型P53蛋白在维持细胞正常生长、抑制恶性增殖种起着重要作用,因而被冠上“基因卫士”的称号。p53基因时刻监控着细胞染色体DNA的完整性,一旦细胞染色体DNA遭到损害,P53蛋白与基因的DNA的相应结合部位结合,起特殊转录因子的作用,活化p21基因转录,使细胞停滞于G1期;抑制解链酶的活性;并与复制因子A相互作用,参与DNA的复制与修复。如果修复失败,P53蛋白即启动程序性死亡(凋亡)过程诱导细胞自杀,阻止有癌变倾向的突变细胞的生成,从而防止细胞恶变。
p53基因蛋白是让全球肿瘤生物学家着迷
国际科学期刊《细胞》杂志发表了一项对p53进行深度研究的报告。p53蛋白能够被多种应激刺激激活,同时它也控制着一个非常复杂的抗增殖转录系统,这一转录系统影响到人体的无数生物反应。
p53蛋白(紫色和黄色)作为一种肿瘤抑制基因
p53是一种调控转录的序列特异性DNA结合蛋白。与p53介导的转录调控在抑制肿瘤中的重要作用一致,大部分肿瘤中出现的TP53基因突变发生在编码p53蛋白DNA结合域的部分。在正常细胞中,p53被一系列调节因子维持在低水平。其中MDM2基因作为p53泛素连接酶,能够促进p53的降解。不过在多种细胞应激情况下p53蛋白在细胞中的稳定性得到提高。激活p53的机制根据刺激的不同而改变,例如,DNA损伤会促进p53的磷酸化,从而阻断MDM2媒介的降解。而致癌基因突变引发的信号通路会诱导ARF肿瘤抑制子抑制MDM2的功能。
p53促进细胞周期停滞(cell cycle arrest)和细胞凋亡(apoptosis)的功能。P53促进细胞周期停滞的目的是为了帮助DNA在进行更多细胞分裂之前获得修复。同时,p53可以通过引导促进凋亡的BCL-2家族成员的表达来促使细胞凋亡的发生。
p53是一个重要的肿瘤抑制蛋白 。一方面,p53在DNA出现损伤后能够引发细胞周期停滞或者消灭细胞,表明它可以通过预防致癌基因突变的累积来防止癌症发生。从这个角度来说,p53缺失会导致存活下来的子细胞中基因突变数目增多,从而间接地促进癌症的发生。另一方面,p53在致癌基因异常表达时能够阻止细胞增殖,表明它可能在限制致癌基因突变的恶果方面也有重要作用。在这种情况下,p53缺失会允许表达致癌基因的细胞继续无限制增殖,从而直接导致癌症发生。不管从哪个角度看,p53都承担着基因卫士职责,它会限制基因突变带来的有害后果。
“基因卫士”P53。当DNA损伤发生时,DNA 损伤反应应激酶会磷酸化p53,激活p53,导致细胞周期停滞、细胞衰老或者细胞凋亡。这些步骤最终可以减少基因突变进一步传播的风险。而且,p53会激活编码DNA修复机制组成部分的基因,从而刺激DNA修复。
另一个功能p53可以通过杀死可能出现异常有丝分裂的细胞来限制染色体不稳定性的产生,特别是在中心体扩增或端粒功能失常之后。多余的中心体可以导致Hippo信号通路的上调,这会通过抑制MDM2来激活p53。有研究表明p53缺失的细胞更容易耐受异常基因剂量造成的蛋白组方面的压力。综合这些原因,p53缺失似乎不但促进非整倍体细胞的产生,而且维持它们的存活。
另一个p53维持基因组完整性的手段是抑制反转录转座子的移动。反转录转座子是病毒生成的遗传元件,它们可能通过在基因组中的转移和重新插入造成基因突变的产生。有研究表明在果蝇中激活可移动的反转录转座子可以导致DNA出现双链断裂,p53引发的细胞凋亡理论上可以减少DNA双链断裂带来的基因突变的可能。但是p53基因突变与反转录转座子表达之间的关系并不只限于消灭出错细胞。
p53 控制着一个广泛而灵活的信号网络
P53调节基因组完整性,细胞周期停滞和细胞凋亡,同时p53还控制更多“非经典”信号通路。例如,p53可以调节自噬活动,改变新陈代谢,抑制多能性和细胞可塑性,并且协助依靠铁离子的细胞死亡方式。即便是基准水平的p53也可以增强多种其它肿瘤抑制信号网络。
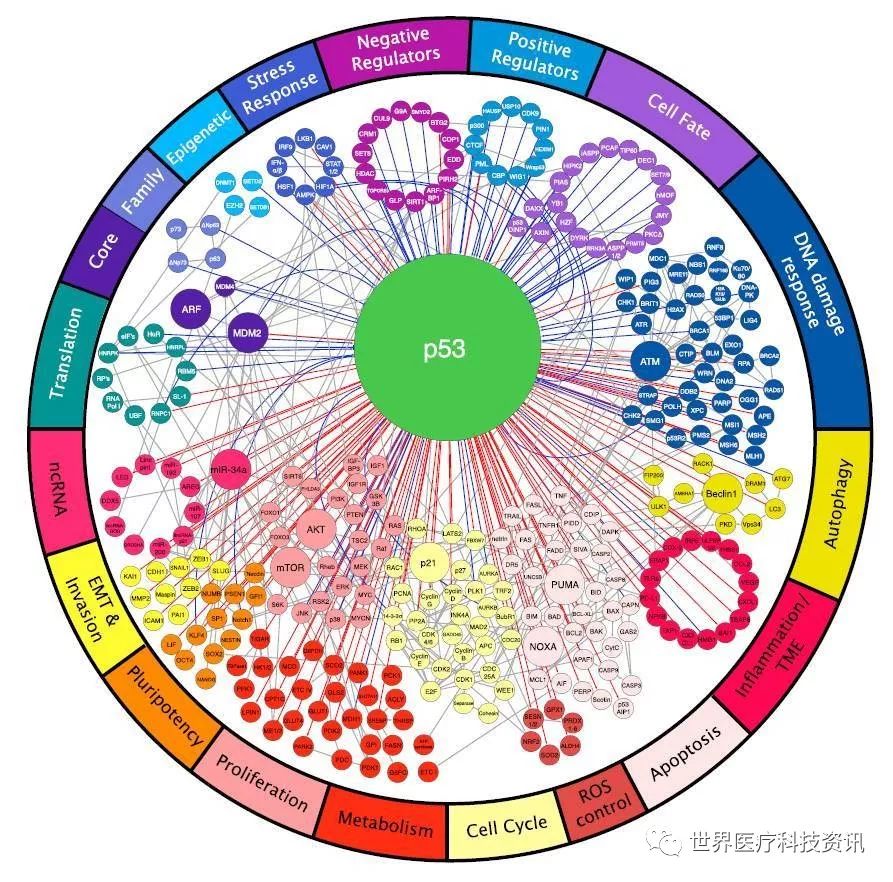
p53信号网络
TP53基因突变的多样性导致不同的功能结果
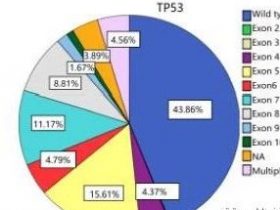
TP53基因位点在肿瘤中的变异方面的研究,通过基因组测序已经证实,大约一半肿瘤至少携带一个p53变异,但是不同类型的肿瘤之间携带p53变异的频率和分布有非常大的差别。大多数在TP53基因中出现的 SNVs是错义突变,其中25%属于5种热点突变。令人意外的是,大约25%的TP53突变是会导致编码截短蛋白的无义或移码突变,剩下的是剪接点SNVs和生理意义不明的片段插入或缺失。虽然有几种渠道可以让第二个TP53等位基因失活,但是这通常是由于片段删除(segmental deletion)而造成的。这些被删除的片段大小不一,出现的频率和SNVs出现的频率相当。大约只有25%的肿瘤携带着典型的p53错义突变/片段删除组合。
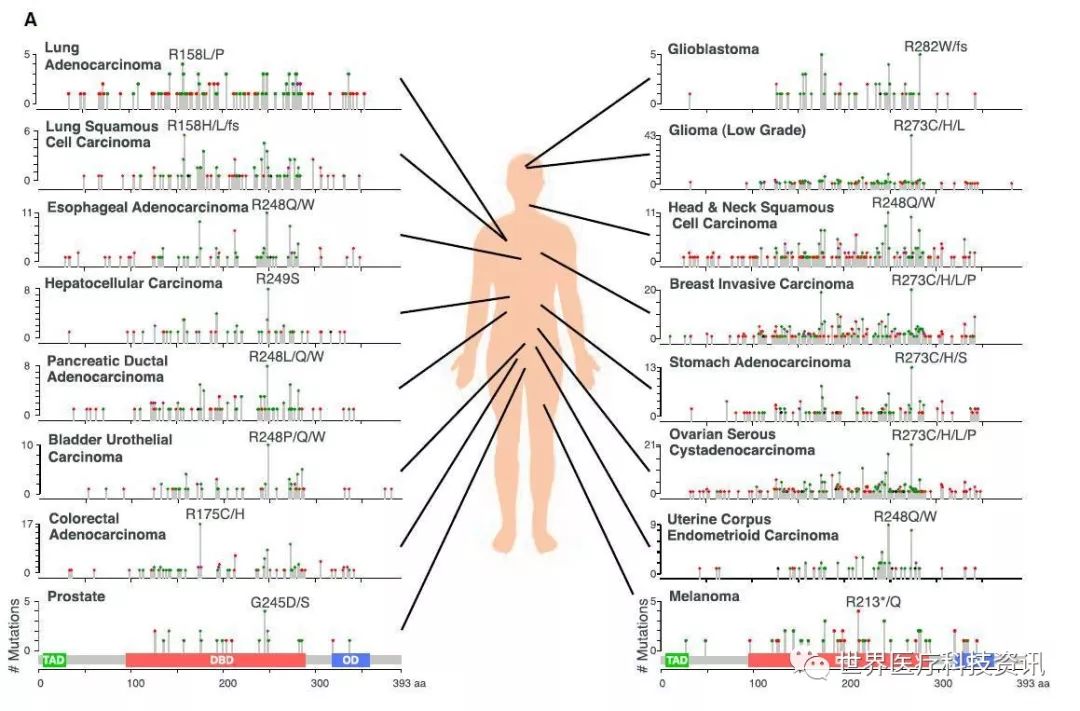
▲16种癌症类型中的常见TP53突变
掌控p53信号网络,抑制突变保持稳定性
目前利用对p53生物学理解进行抗癌药物研发中,进展最快的项目是抑制携带野生型p53的肿瘤中的MDM2。以Nutlin为首,一系列抑制MDM2和MDMX的小分子和肽基抑制剂被开发出来。它们通过靶向MDM2中与p53的结合位点来防止p53的降解。MDM2拮抗剂在白血病和脂肪肉瘤中已经完成一系列临床1期试验。虽然这些剂量递增试验不能对药物疗效作出结论,但是在大多p53野生型样本中观察到了p53靶点基因的表达量增加。而且在5~10%的患者中观察到了部分反应,这是一个好的预兆,因为这些患者中很多已经接受过多种疗法的治疗。
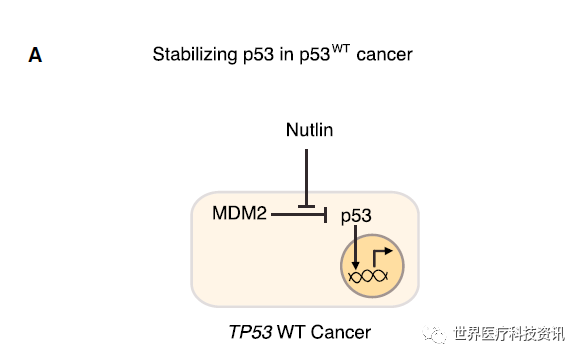
▲p53治疗策略:在p53野生型肿瘤中保持p53稳定性
在另一种情况下,MDM2抑制剂被用来减少化疗的毒副作用。在这种策略中,这些药物被用来在正常细胞中提高p53的稳定性,从而触发暂时的细胞周期停滞。这一做法的目的是对于携带p53突变的肿瘤细胞来说这些药物对细胞周期周转没有作用。因为细胞毒性药物靶向积极分裂的细胞,这一策略可以提高化疗药物的使用剂量,在增强对分裂的癌细胞的疗效同时降低对细胞周期停滞的正常细胞的副作用。
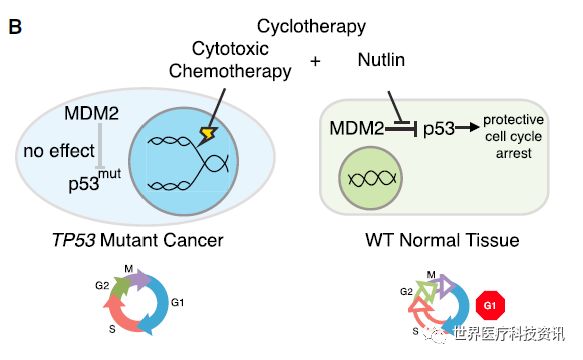
▲p53治疗策略:采用MDM2抑制剂减少化疗的毒副作用
另一种吸引人的策略是发现能够让p53突变蛋白重新获得野生型p53的肿瘤抑制活性的药物。虽然达到这一目标的热力学要求是一个严峻的挑战,但是蛋白结构研究和电脑模型预测已经发现了多个策略在概念上证明这一方法的可行性。其中包括可以让非结构化突变蛋白结构稳定下来的小分子和多肽。一种名为APR-246的药物据称可以重新激活p53突变蛋白但是具有脱靶效应,该药物现在正在进行临床试验。其它直接稳定p53的DNA结合蛋白域的药物在临床前实验中表现出可喜的前景。被称为金属伴侣(metallochaperons)的药物能够帮助展开的蛋白(unfolded protein)与锌离子结合并且形成一个较为正常的构像,从而恢复与DNA结合的能力。而另一种策略利用了一个意想不到的发现,那就是有些p53突变蛋白有形成像淀粉样蛋白一样的聚合物的倾向,当聚合过程被扰乱后,p53的功能可以得到恢复并且在异种移植模型中触发肿瘤萎缩。
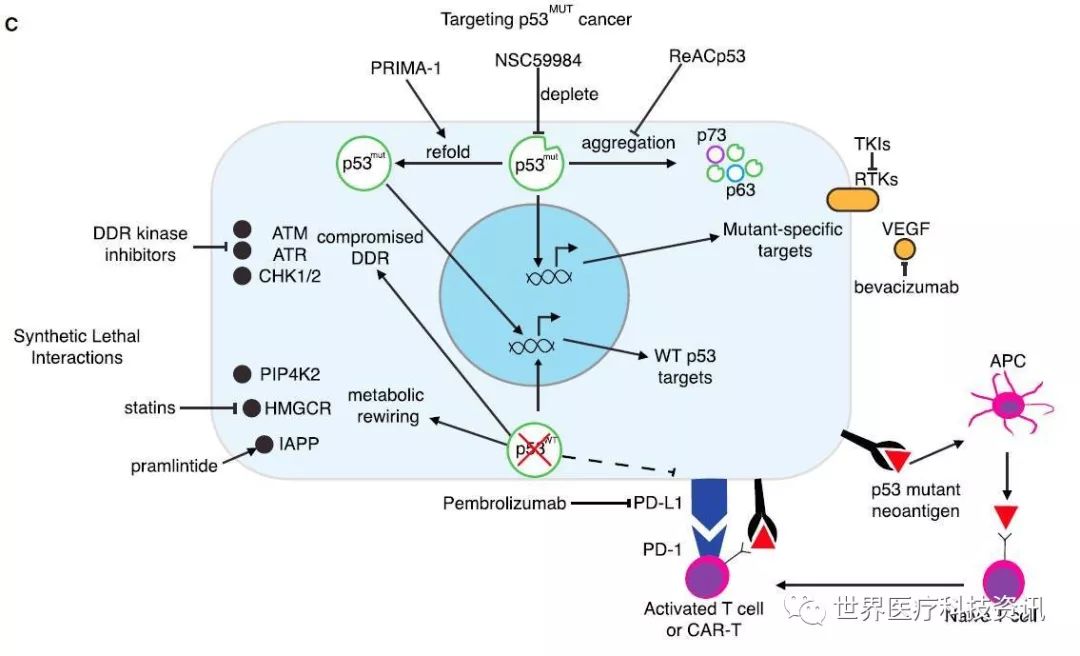
▲p53治疗策略:靶向p53突变的肿瘤
除了利用药物恢复突变蛋白中野生型的活性以外,另外一种策略是抑制p53突变蛋白的活性,因为有些肿瘤会依赖于p53突变蛋白的功能。在无法直接抑制p53突变蛋白活性的情况下,仍然可以有方法间接靶向p53突变蛋白促进肿瘤细胞侵袭、转移和存活的机制。
另一种直接攻击p53突变蛋白的方法是利用它可能成为具有肿瘤特异性的新抗原(neoantigen)的潜力。p53突变蛋白通常表达量很高而且具备抗原特性。而且针对p53突变蛋白的疫苗在小鼠模型中已经取得了一定成功。基于这个想法,多肽疫苗,病毒载体和树突状细胞疫苗已经进入临床1/2期试验。不管基于哪种平台,免疫疗法已经能够引发针对p53的免疫反应。
理论上逃脱免疫编辑的肿瘤更可能携带激发免疫反应的新抗原。因此将p53免疫疗法与增强T细胞反应的免疫检查点抑制剂结合起来,可能将针对p53的T细胞转化为抗癌武器。
另一个靶向携带p53突变蛋白肿瘤的具有吸引力的策略是利用合成致死概念。很多p53突变蛋白造成的弱点与DDR和新陈代谢相关。虽然p53缺失的细胞在面对损伤DNA药物时能够避免细胞凋亡,但是进一步破坏DDR系统会让携带p53突变的肿瘤对遗传毒性损伤非常敏感。因此,人们正在开发将造成DNA损伤的药物与抑制DDR系统中的ATM, CHK2, ATR和CHK1的抑制剂联合使用的策略。虽然加剧基因组不稳定性可能达到治疗效果,但是一个顾虑是削弱DDR导致的基因突变可能进一步加快肿瘤进化。
通过恢复野生型功能,抑制突变蛋白功能,或者靶向失控的免疫系统,有多种渠道可以靶向癌症中的p53信号网络。目前使用这些策略时面对的挑战表明,进一步理解p53的基本生物学机制对未来临床应用的成功非常重要。
划时代的伟大发现:氯硝柳胺成功抑制广泛性P53缺陷肿瘤
意大利和新加坡的癌症科学研究团队的R.Kumar和B.Somalanka等人的一项最新研究表明一种用于治疗绦虫感染的药物可以用于治疗一系列癌症。超过一半的癌症病人肿瘤中的抑癌基因p53存在突变,这使得p53成为了一个极具吸引力的抗癌靶点。
p53基因突变是在各种类型的人类癌症中最常见的出现的一个。因此,靶向p53缺乏对于大量人类癌症具有很大的希望。特别是由野生型p53功能丧失所产生的靶向脆弱性可提供靶向广谱p53突变的手段,包括热点错义和无义突变。希望这种方法扩大药物的治疗窗口,使正常细胞受到最小程度的影响。
鉴于临床中p53突变的大量异质性,直接靶向突变型p53蛋白存在相当大的挑战。另一种方法是利用由野生型p53失去的改变的细胞适应性。在这里,研究团队通过HTS筛选鉴定氯硝柳胺,用于选择性杀死p53缺陷细胞的化合物。氯硝柳胺损害p53缺陷细胞和p53突变体患者衍生的卵巢异种移植物的生长。代谢组分析显示氯硝柳胺诱导线粒体解偶联,这使得突变型p53细胞通过花生四烯酸(AA)的优先积累而对线粒体依赖性细胞凋亡敏感,并且代表p53突变体肿瘤的一流抑制剂。野生型p53通过促进两种关键脂质氧合基因的转录诱导来逃避细胞毒性,ALOX5和ALOX12B,催化AA的分解和分解。因此,研究团队提出了一种新的途径,通过利用它们对氯硝柳胺诱导的线粒体解偶联的易感性来靶向p53途径缺陷的癌症。
许多研究聚焦于直接或者间接恢复突变细胞中的p53功能,但是Chit Fang Cheok领导的研究团队采用了一种不同的策略。他们并没有尝试修复突变的p53,因为这个基因在不同的癌症中突变方式不同,他们通过研究p53缺陷的细胞和正常细胞之间的差别来探索治疗p53缺陷的癌细胞的新方法,Cheok称之为靶向p53的缺失(功能丢失)。
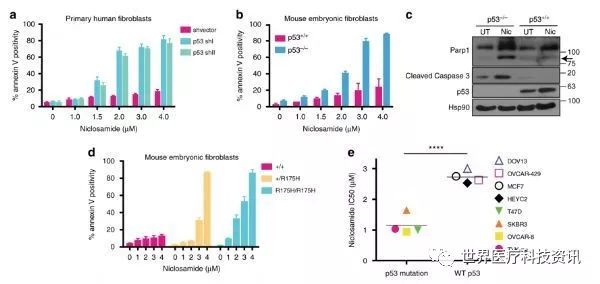
该研究团队利用携带正常p53和突变p53的结肠癌细胞检测了1600种FDA批准的药物,结果发现杀伤p53缺陷的癌细胞(而非p53正常的癌细胞)的能力最强的药物是氯硝柳胺——一种用于治疗绦虫感染的药物。随后的测试表明氯硝柳胺还可以有效杀伤p53突变的其他癌细胞系。
图片来源:Nature Communications
由于p53控制着广泛的信号网络,因此p53功能的缺失可能与细胞中“适应性”的改变有关,这可能会破坏其基因组稳定性和代谢适应性。证据表明,p53的缺失易患细胞从缺乏PI5P4Kα/β丝氨酸饥饿和ROS诱导的死亡例示消除p53基因突变的细胞的潜在用途合成致死的。然而,尽管在各种代谢途径中发现p53的新功能方面取得了进展,但是用于治疗益处的这些复杂途径的药理学操作仍然具有挑战性。能够触发最佳保护性p53活化同时在突变细胞中诱导细胞毒性的药物策略将是治疗性翻译的理想选择。
氯硝柳胺是自1960年获得美国食品和药物管理局(FDA)在肠道绦虫感染的治疗人类使用的口服水杨衍生物。氯硝柳胺是氢离子载体跨越导致线粒体解偶联线粒体膜易位质子和葡萄糖和脂肪酸氧化的无效循环。它作为温和线粒体解偶联剂的作用足以杀死驻留在胃肠道中的绦虫。它在人类出色的安全性(不同于2,4-二硝基苯酚DNP)为瞬态轻度线粒体解是可容忍在正常细胞中。氯硝柳胺最近的特征在于用于在用途糖尿病,寨卡病毒感染和各种癌症适应症,包括成胶质细胞瘤的人类肿瘤,结肠癌和卵巢癌的细胞在体外。报告表明,氯硝柳胺抑制肿瘤生长促进通路,包括WNT /β-连环蛋白,STAT3,陷波,和mTOR途径,然而,它的确切抗肿瘤作用机制还不完全清楚。
在这项研究中,研究团队设计了一个基于图像的共培养筛选,以识别对p53缺陷肿瘤细胞合成致死的化合物。我们确定了氯硝柳胺在野生型细胞中同时激活p53促存活功能的同时有效促进缺乏p53功能的细胞凋亡,包括人和小鼠来源。从机制上讲,p53活化与脂质氧合基因的转录诱导相结合,抵消了氯硝柳胺赋予的代谢应激。总之,我们的研究揭示了氯硝柳胺靶向的p53缺陷细胞中出乎意料的代谢脆弱性,并支持氯硝柳胺作为针对缺乏p53功能的广谱肿瘤的一流药物的潜在用途。
重新利用氯硝柳胺靶向p53缺陷
研究团队对PHARMAKON图书馆的1600种FDA批准的化合物进行了HTS筛查。为了选择合成杀死p53缺陷肿瘤细胞的化合物,我们开发了一个强大而灵敏的基于图像的筛选,使用新生成的HCT116 p53 + / +和p53 - / -表达组蛋白2B(H2B)-GFP和组蛋白的稳定细胞系。2B(H2B)-RFP融合蛋白分别(图 1a)30。在共培养物中筛选细胞系,并使用自动图像采集和存活的GFP和RFP阳性细胞的定量分析评估每种细胞系对化合物的相对耐受性。
图。1
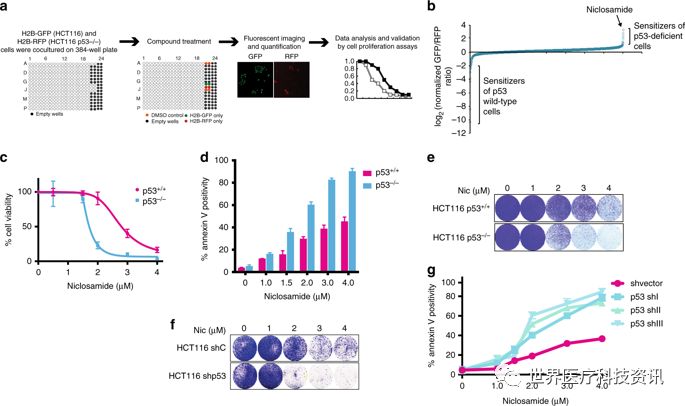
图片来源:Nature Communications
研究结果提供了明确的证据,即由于失活点突变或完全丧失p53蛋白而导致的野生型p53功能丧失,使不同物种和组织来源的正常细胞和癌细胞对氯硝柳胺敏感。
氯硝柳胺通过干扰线粒体产能以及引起脂肪酸代谢的改变来影响细胞。实验显示线粒体的解偶联是氯硝柳胺选择性杀伤p53突变细胞的基本方式,但是这不足以完全解释这个现象,因为p53正常的细胞中也出现了相同程度的线粒体解偶联。换句话讲,在此研究之前科学家们不清楚为什么这种药物可以更有效杀伤p53突变的细胞。
研究人员检测了氯硝柳胺治疗的细胞的代谢,结果发现p53突变的细胞中一种叫做花生四烯酸的脂肪酸含量显著增加。他们的进一步分析发现氯硝柳胺引起的线粒体解偶联会增加细胞中的钙离子浓度,从而加速花生四烯酸的产生。该研究团队发现p53可以通过开启两个可以降解花生四烯酸的基因ALOX5和AOX12B来应对这种变化。而p53突变的细胞中这些基因不会被激活,这使得花生四烯酸持续富集,从而引起线粒体释放细胞色素c,导致程序性细胞死亡。未来的工作将进一步寻找其他可以激活相同信号通路以治疗p53突变肿瘤的药物。
“我们将这些信息以一种令人惊讶的方式结合起来了,这让我们很兴奋。”Cheok说道。为了验证他们的模型,研究人员敲除了p53正常的细胞中的ALOX5和AOX12B,结果发现这些细胞对氯硝柳胺的敏感性增加,而敲除p53缺陷的细胞中的ALOX5和AOX12B并不会增加这些细胞对氯硝柳胺的敏感性。最后,研究人员确认了氯硝柳胺可以更有效地治疗动物身上p53缺陷的肿瘤。他们将培养的细胞注射到小鼠体内,经过氯硝柳胺治疗后监控肿瘤的生长,结果发现氯硝柳胺可以将p53缺陷的肿瘤的生长速度降低一半,而对p53正常的肿瘤无影响。
在这里描述了使用氯硝柳胺作为单一药剂同时激活p53促生存功能,同时在p53突变体/敲除细胞中产生急性代谢应激和细胞毒性。我们发现p53通过可逆地激活脂质氧合基因ALOX5和ALOX12B来响应急性剂量的氯硝柳胺来控制细胞命运决定(图 8h)。ALOX5和ALOX12B(花生四烯酸)的底物是氯硝柳胺诱导的代谢应激的核心。野生型p53活性丧失导致花生四烯酸显着积累,细胞色素c释放增加,胱天蛋白酶9/3活化和凋亡增加(图 8h))。重要的是,氯硝柳胺对p53缺陷细胞的选择性在体内肿瘤模型中重现,导致与卵巢患者衍生的异种移植模型中的野生型p53肿瘤相比,对p53突变肿瘤的抗肿瘤发生作用增加。
我们描述了一种新的p53-ALOX5 / 12B轴,可保护野生型细胞免受氯硝柳胺的侵害。我们的数据指出氯硝柳胺作用的新机制依赖于其线粒体解偶联活性诱导细胞内钙通量。细胞内Ca 2+的增加会触发许多酶的活化,包括那些水解磷脂的酶,如磷脂酶A2 50,导致花生四烯酸的释放(图 8h))。显然,我们发现钙螯合剂或细胞内钙释放抑制剂以及细胞溶质PLA2抑制剂减弱了氯硝柳胺的作用。与此一致,代谢组分析揭示了磷脂组分的增加,即LysoPE和LysoPC,其在磷脂酶A2水解磷脂的sn-2酰基键时除了花生四烯酸外还释放。该途径通过多种酶的作用提供前体,用于产生白三烯,血栓素和前列腺素等,随后代谢花生四烯酸35。我们的数据表明,p53缺陷细胞中其他AA代谢酶的存在显然不足以阻止细胞内AA的灾难性积累。然而,在野生型细胞中,ALOX5和ALOX12B基因的显着药物诱导的p53依赖性转录激活阻止了AA的产生和转换率的不平衡。通过敲低实验,我们剖析了将p53活化与氯硝柳胺敏感性联系起来的关键成分,并鉴定出ALOX5和ALOX12B是氯硝柳胺反应的重要调节剂。总之,我们的发现将p53-ALOX5 / 12B轴置于氯硝柳胺处理后调节代谢稳态和促存活功能的核心。
虽然最近的报道暗示氯硝柳胺通过抑制Wnt,Notch,mTOR和STAT3途径抑制肿瘤生长,但其确切的抗肿瘤机制尚不清楚。在这里,我们首次将p53鉴定为氯硝柳胺反应的关键决定因素,并证明即使在HCT116的Wnt /β-连环蛋白突变体背景中,p53基因的敲除也显着增加细胞凋亡。在Wnt /β-连环蛋白突变体背景中p53敲除增加的氯硝柳胺敏感性不是因为p53缺失以某种方式改变Wnt信号传导途径并增强Wnt靶向药物的作用,因为Wnt抑制剂不会引起p53缺陷细胞的任何优先死亡(补充图 3f)。相反,这意味着p53调节独立于Wnt途径的另一种机制,至少在这种情况下,调节细胞对氯硝柳胺的反应。在这里我们意外地揭示了氯硝柳胺诱导的线粒体解偶联影响正常的磷脂生物发生并通过p53途径激活稳态反应机制。
关于p53突变肿瘤的潜在治疗的最激动人心的观察结果是氯硝柳胺比野生型肿瘤更有效地回归p53突变体肿瘤,如本文使用人卵巢PDX小鼠模型和同基因细胞系异种移植模型所证明的。删除HCT116 p53 中的p53基因- / -使得肿瘤异种移植物对氯硝柳胺处理显着更敏感(图 8a,b),并且我们建立的卵巢PDX模型中的p53突变也是如此。与野生型细胞相比,氯硝柳胺对携带不同p53点突变(p53R175H)或p53基因位点(p53 - / -)基因敲除的MEF的效力显着增加(图。 2b,d)。此外,由于这种治疗方法针对功能丧失的野生型p53而不是特定的p53点突变或缺陷,这种方法可能对包含p53途径缺陷的广谱肿瘤有效,包括灭活点p53的突变和缺失基因,并在体内耐受良好。实际上,我们的动物研究还表明,氯硝柳胺具有良好的耐受性,并且在口服给药过程中没有报道对小鼠体重和生理的不良影响。这与基于细胞的研究一致,显示正常细胞对氯硝柳胺的良好耐受性和未转化背景中p53的丧失,对氯硝柳胺敏感性产生实质性影响。总之,结果表明氯硝柳胺诱导通过p53介导的促存活机制,可通过同时激活p53和在损失驱动的肿瘤中诱导花生四烯酸/细胞色素c凋亡反应来利用肿瘤特异性靶向。 p53
重要的是,p53-ALOX5 / ALOX12B途径组分的表达可用于肿瘤分层和直接氯硝柳胺治疗可能有反应的那些。我们利用大规模转录组学的进步,允许对广泛的肿瘤数据集进行询问,以识别和验证新的基因 - 基因关系,并提供相应区分癌症群的方法。TCGA RNA-seq转录组学数据显示ALOX5和ALOX12B基因表达与野生型p53基因特征48之间存在显着相关性(图 6h和补充图 6 h -n))。这提供了一个令人信服的建议,即除了p53基因标记外,ALOX5和ALOX12B的加入将提供临床注释的基因标记,可以潜在地用作氯硝柳胺反应的预测因子。
此外,其他平行机制,如p53基因的杂合性缺失伴随着17p13.1的缺失,已知会驱动侵袭性肿瘤表型,可能会因偶然缺失ALOX12 / 15而促进花生四烯酸积累。基因51并为氯硝柳胺治疗这一类侵袭性人类肿瘤提供了另一种治疗机会。
该研究提供了直接证据,即p53的缺失/突变和脂质氧合基因的受损表达赋予对氯硝柳胺的改善的治疗反应。我们为以前未知的氯硝柳胺作用机制提供了新的见解,并突出了使用氯硝柳胺对抗p53突变的抗癌治疗的新的令人兴奋的治疗机会。
基于他们的发现,研究人员已经为这项研究申请了专利,由于这种药物是靶向p53缺陷,而非靶向特殊的基因突变,因此它将适用于更大范围的p53突变的肿瘤。氯硝柳胺已经在人体身上使用了数十年,被WHO列为一种有效、安全而便宜的药物,这使得它成为一种可能治疗一系列p53缺陷肿瘤的救命良药。
参考资料:
Mitochondrial uncoupling reveals a novel therapeutic opportunity for p53-defective cancers
Published26 September 2018
Nature Communications volume 9, Article number: 3931 (2018)
DOI https://doi.org/10.1038/s41467-018-05805-1
https://www.nature.com/articles/s41467-018-05805-1