- A+
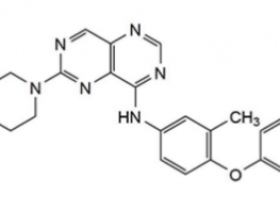
EGFR T790M突变是第一代/第二代EGFR TKI耐药的主要机制,随后,奥希替尼被开发用于选择性地抑制EGFR T790M和EGFR敏感突变并显示出较好疗效。奥希替尼的成功应用被认为是耐药机制基础上调整靶向治疗方案的成功范例。随着奥希替尼在一线和二线治疗的应用和经验的积累,复杂的耐药机制也慢慢浮现,识别这些耐药机制是未来治疗方案的关键所在。
获得性耐药机制主要分为两种:依赖EGFR通路的作用机制(on-tagert)例如EGFR T790M二次突变,EGFR非依赖作用机制(脱靶,off-tagert)——利用旁路激活信号通路或其他通路转移肿瘤细胞对EGFR信号通路的依赖。脱靶耐药机制包括下游信号通路的激活,例如Ras或PI3K信号通路。
对第一/二代EGFR TKI的获得性耐药主要依赖EGFR途径,EGFR T790M是主要耐药机制,在49%~ 63%的患者中发生,其他耐药突变如EGFR D761Y也会发生,但不常见。最常见的脱靶耐药机制包括MET扩增和HER2。MET扩增预计发生在5%~20%的患者中,HER2扩增发生于高达8%的患者。小细胞肺癌组织学转化(5%~14%)也是值得注意的耐药机制之一。
多个研究分析了接受第一/二代EGFR TKI治疗进展再接受奥希替尼治疗NSCLC患者的耐药情况。结果显示,奥希替尼的耐药机制很少依赖EGFR途径,这可能反映了更好地抑制了EGFR途径,以及选择性压力下的分化和细胞克隆进化。这种情况下,仅15%~32%的患者为EGFR途径依赖的三次EGFR突变,并最常发生在EGFR C797位点,即奥希替尼与EGFR的结合位点。其他三次EGFR 突变为G724、L792、L718和G719,这些位点似乎阻碍了奥希替尼与EGFR的结合,而导致耐药。二线奥希替尼的耐药机制多由脱靶机制介导,与HER受体酪氨酸激酶家族密切相关,包括MET扩增(激活下游HER3)(6%~26%)、EGFR(0%~36%)和HER2(0%~8%)。有趣的是,还发现了其他奥希替尼的获得性耐药机制,例如ALK融合、BRAF V600E突变、HER2插入、KRAS突变、NTRK融合、FGFR融合、RET融合和MET外显子14突变。
- 新发现:HER2D16
HER2突变包括扩增(1%~5%)和突变(主要是外显子20的框内插入)(2%~4%)可能是肺腺癌的致癌驱动基因,之前也曾被认为是奥希替尼的耐药机制之一。既往研究显示,外显子16 HER2跳变(HER2D16)出现在乳腺癌细胞中。但Hsu的研究显示,表达HER2D16的H1975细胞系(EGFR T790M/L858R阳性细胞系)对奥希替尼耐药,相应地,HER2D16介导的耐药对src抑制剂±奥希替尼不敏感,而奥希替尼+阿法替尼可克服这种耐药模式。这个案例强调,在EGFR TKI治疗的多个时间节点重复进行分子分析的重要性,新的靶点可能由此发现。
- 奥希替尼耐药:靶向致癌基因
例如,在二线奥希替尼治疗的研究中,36%的患者通过可靶向致癌基因对奥希替尼产生耐药,其中,约一半的患者被证明是MET扩增,并正在进行临床试验以评估c-MET抑制剂联合奥希替尼的疗效。例如TATTON研究和ORCHARD研究试验。相关的研究有,奥希替尼+T-DM1已被证明可克服HER2扩增介导的EGFR-T790M阳性NSCLC细胞系的耐药。也有研究显示,其他联合方式例如奥希替尼联合克唑替尼、MEK抑制剂、BRAF V600E抑制剂等可有效克服奥希替尼获得性耐药。
- 其他相关研究进展
HER3过表达发现于57%-67%的EGFR突变患者中,U3-1402主要针对HER3过表达而开发。2019年ASCO大会上,一项I期临床研究中,既往接受EGFR TKI(包括第一/二代EGFR TKI、奥希替尼)治疗进展的患者接受U3-1402治疗。结果显示,研究共纳入23例患者,在可评估的16例患者中,所有患者肿瘤都有减少,疾病控制率达到100%。U3-1402的抗肿瘤活性可针对EGFR TKI的不同耐药机制。
JNJ-372是一种靶向EGFR及cMET的人源化双特异性IgG1抗体,2019年ASCO大会的新数据显示,在108例经治EGFR突变晚期NSCLC患者中,包括58例三代EGFR-TKI耐药患者和27例EGFR 20外显子插入患者,总人群的ORR为30%,DCR为100%。JNJ-372对各种EGFR突变亚型患者均有抗肿瘤活性,包括奥希替尼后EGFR C797S、cMET耐药、TKI初治时20外显子插入突变。
新数据显示,与二线奥希替尼相比,一线奥希替尼的耐药可能更依赖于脱靶途径。在FLAURA研究一线奥希替尼的分析中,仅8%的患者(7/91)是EGFR C797S突变,远低于之前报道的后线奥希替尼产生EGFR C797X的突变频率,32%患者为脱靶耐药机制,但研究仅使用了血浆基因分型,未鉴定组织学基因。研究显示,组织学类型转化可能占奥希替尼耐药的14%~20%。因此,肿瘤组织活检也是发现和探索奥希替尼耐药机制的关键所在。
在相关研究中,使用第二代测序未发现驱动基因,而进一步的RNA测序在14%患者中发现了未知融合和MET外显子14突变。因此,若外显子组测序未发现耐药机制时,可通过RNA测序技术进一步探索分析。
目前,在二线和一线奥希替尼的患者中分别有40%和50%的患者还没有明确的耐药机制。未来的研究需要深入和全面地进行DNA、RNA和蛋白质表达分析以揭秘未知的耐药机制。
参考文献:
1. Schoenfeld AJ, Yu HA. The Evolving Landscape of Resistance to Osimertinib. J Thorac Oncol. 2020;15(1):18–21. doi:10.1016/j.jtho.2019.11.005
2. Tang ZH, Lu JJ. Osimertinib resistance in non-small cell lung cancer: Mechanisms and therapeutic strategies. Cancer Lett. 2018;420:242–246. doi:10.1016/j.canlet.2018.02.004