- A+
氟嘧啶联合基于铂的化疗为食道及胃肿瘤的标准一线全身性治疗。对于人表皮生长因子受体2(HER2/ERBB2)阳性患者,曲妥珠单抗联合化疗为标准治疗方案。帕博利珠单抗和纳武利尤单抗获准用于化疗难治性食道及胃肿瘤患者。帕博利珠单抗日前被美国批准用于PD-L1阳性或高MSI(MSI-H)食道及胃肿瘤的治疗。然而,PD-L1表达状态未能预测纳武利尤单抗的治疗所带来的生存期。
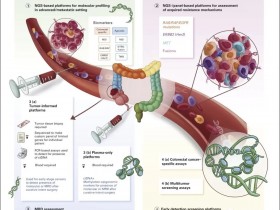
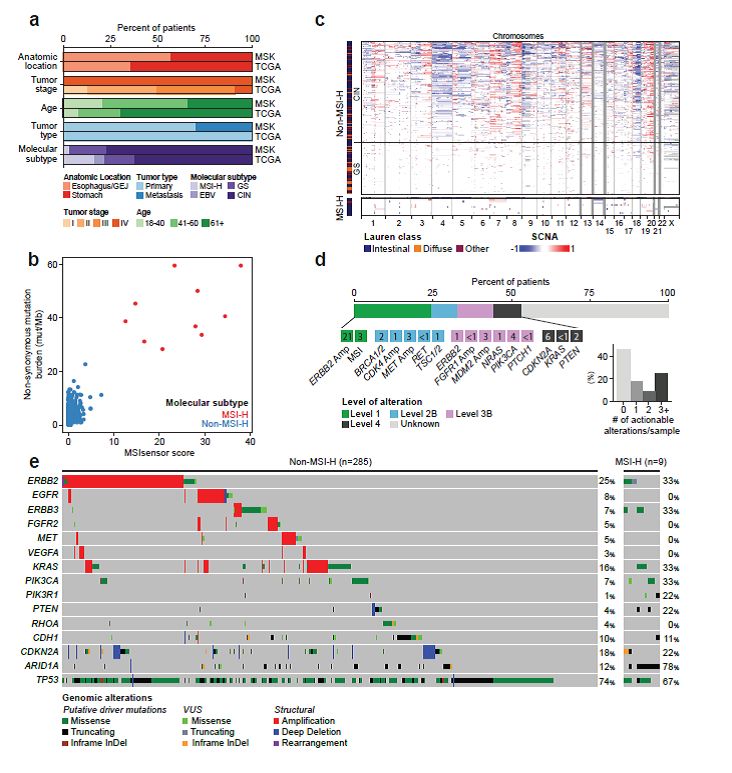
尽管日前治疗选择增多,但食道及胃肿瘤患者对全身性治疗的应答概率较低,疗效维持时间较短,存活超过5年的晚期患者不足5%。为了鉴别出疗效预测生物标志物和曲妥珠单抗及免疫检查点抑制剂耐药的分子机制,并开发合理的联合治疗策略,研究者对复发或转移性食道及胃肿瘤患者进行了前瞻性NGS测序及临诊病理学分析。
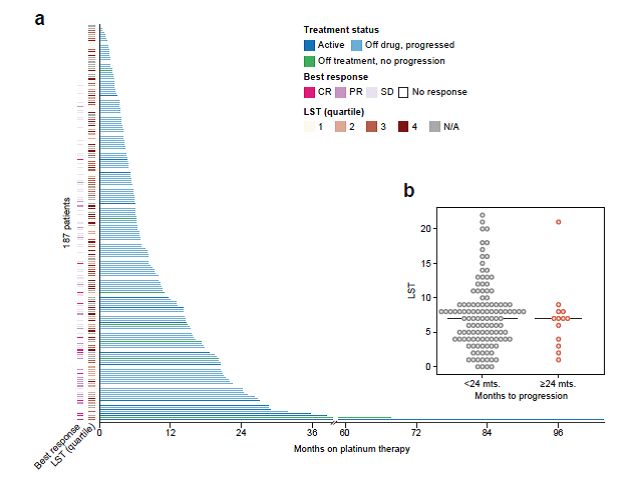
全身性治疗应答的潜在生物标志物:在分析中,并没有哪一个基因的突变(包括在DNA修复中起作用的基因,如BRCA1/2)与治疗应答显著相关(图2)。大规模转移评分(为HRD的一个替代指标)不能预测患者接受化疗的无进展生存期(HR,0.99;P=0.947),及患者在一线治疗应答是否可以持续24个月(p =0.6)(图2)。值得注意的是,多数对铂二联化疗应答期显著延长的患者,并未检出肿瘤细胞有任何突变。
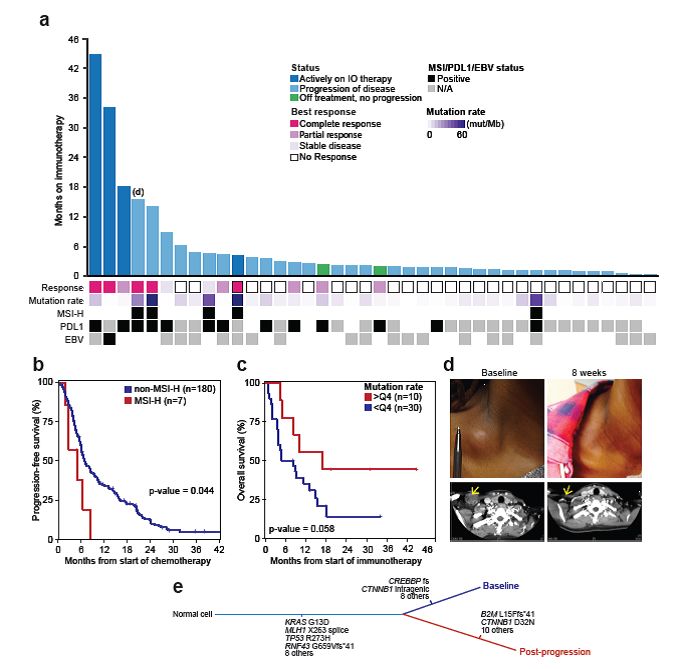
免疫检查点抑制剂应答的潜在生物标志物:MSI-H肿瘤患者在接受标准细胞毒治疗时会快速疾病进展,与非MSI-H患者相比,一线化疗的PFS显著性短(4.8 vs 6.9个月;HR,0.4;P=0.027)(图3)。鉴于测序结果与之前研究表示的其他肿瘤类型的MSI-H患者可对免疫检查点抑制剂产生应答,标准细胞毒化疗后进展的食道及胃肿瘤MSI-H患者首选免疫治疗。本研究中,总计5名MSI-H和35名非MSI-H患者接受了免疫检查点抑制剂治疗,开始治疗的时间从0.3到44.7个月(图3)。除了5名MSI-H患者,虽然28%的非MSI-H患者在免疫治疗后实现影像学肿瘤消退,但应答通常十分短暂,应答持续时间常少于6个月。另一方面,5名MSI-H患者尽管标准化疗后疾病快速进展,但是初始免疫治疗后仍然存活了19.5~44.7个月。较高的肿瘤突变负荷与更好的免疫治疗结局相关,最高四分位数肿瘤负担的患者具有更佳的预后(OS:16.8 vs 6.62个月;2年OS率:44% vs 14%;HR,0.40;P=0.058)。
另外,值得注意的是,研究队列中仅有的1例EBV阳性患者的应答持续时间更长。
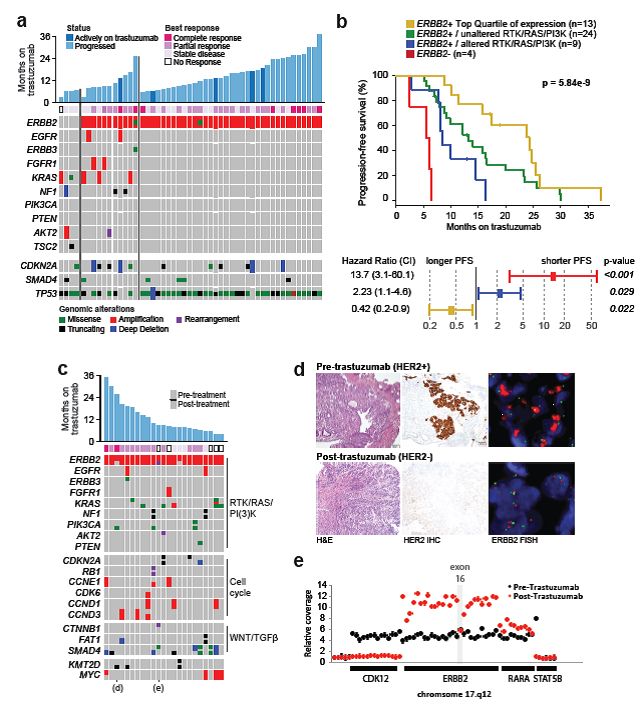
与曲妥珠单抗耐药相关的因素:MSK队列中,68例为HER2阳性。ERBB2拷贝数与HER2 IHC/FISH之间具有显著相关性。FISH显示的ERBB2扩增水平可预测曲妥珠单抗治疗转移性胃肿瘤患者的敏感性和生存期的延长。此外,研究者也观察到,NGS量化的ERBB2扩增水平和一线曲妥珠单抗治疗者PFS之间具有强烈的相关性,最高四分位数ERBB2扩增水平的患者具有显著性长的PFS(中位24.3个月)(图4)。同时具有RKT-RAS-PI3K/AKT通路基因突变的患者具有更短的PFS(中位8.4个月),表明激活该通路可造成曲妥珠单抗本质性耐药(图4)。多变量分析显示,ERBB2水平和PI2K通路的突变都可独立促进无进展生存期的差异。
对于曲妥珠单抗获得性耐药机制,研究者发现,缺乏ERBB2扩增、ERBB2外显子16缺失和受体酪氨酸激酶、RAS、PI3K通路共突变与获得性耐药相关。
该研究也强调,食道及胃肿瘤的肿瘤异质性非常强,从疾病单一部位采样不能完全评估克隆复杂性和肿瘤异质性。因此,将来可开展ctDNA的相关研究,能够更好的诠释肿瘤的状态,用以指导精准治疗。