- A+
李敬杰,陈亚伟,都潇,等.2018年肿瘤基因检测大事盘点[J].肿瘤综合治疗电子杂志,2019,5(1):27-34.
二代测序(next-generation sequencing, NGS)技术是近年来发展最为迅速的基因检测的技术方法,在精准诊疗的医学模式下具有广阔的应用前景。一方面靶向治疗新靶点的突破性进展和耐药机制的阐明,让 NGS 的临床应用成为趋势,另一方面基于血液中循环肿瘤 DNA(circulating tumor DNA,ctDNA)的基因检测技术逐渐得到认可,让动态的基因监测成为可能。同时在免疫治疗备受瞩目的今天,基因检测相关的分子标志物也有着重要的临床价值。本文将分类盘点近期在主要国际国内肿瘤会议和顶级临床期刊上公布和发表的重要临床研究,以便读者快速全面了解基因检测的最新进展和未来趋势。
1.1 EGFR/HER2的20号外显子插入
内皮生长因子受体(endothelial growth factor receptor,EGFR)/人类表皮生长因子受体2(human epidermal growth factor receptor-2,HER-2)的20号外显子突变患者的缓解较差,属于难治性肺癌患者,其中部分患者应用一代、二代、三代EGFR-酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)均无效。Poziotinib的出现弥补了这一不足,显示出良好的抗肿瘤活性,相关研究在2018年的世界肺癌大会(World Conference on Lung Cancer,WCLC)中做了报告。该研究分为2个队列,队列1为EGFRExon20突变NSCLC患者50例,队列2为HER-2Exon20突变患者30例。结果表明,Poziotinib对EGFR/HER2Exon20突变的非小细胞肺癌(non-smallcell lung cancer,NSCLC)患者具有良好的抗肿瘤活性,EGFRExon20突变患者的客观缓解率(objective response rate,ORR)为43%,HER-2患者队列中半数(6/12)患者实现明显的缓解,4例患者疾病稳定[1]。针对EGFR/HER-2Exon20患者进行的多中心研究正在进行,包括一线治疗队列和泛癌种篮子试验。除此之外,针对HER-2突变患者的新型靶向药的研发和筛选靶向药获益人群的研究也获得了一些进展。
1.2 NTRK基因融合
NTRK基因融合是一种驱动突变。NTRK基因包含NTRK1、NTRK2、NTRK3,分别表达TRKA、TRKB、TRKC蛋白。NTRK基因融合在罕见肿瘤中的出现频率较高,如分泌性乳腺癌、乳腺癌类似物分泌性癌、细胞或混合先天性中胚层肾瘤和婴幼儿纤维肉瘤中的频率可能超过90%,在肺癌、肠癌、胰腺癌、乳腺癌、黑色素瘤等常见肿瘤中的发生频率通常小于1%[2]。2018年11月27日,美国食品和药物管理局(Food and Drug Administration,FDA)加速批准了一款靶向药物Larotrectinib,用于NTRK融合的多个癌种的治疗。这是继帕博利珠单抗之后的第2个不以癌种划分而是以生物标志物为指导的精准治疗药物。在篮子试验中,ORR达到81%,部分缓解(partial response,PR)患者占63%,完全缓解患者(complete response,CR)占17%。另一NTRK靶向药物恩曲替尼的临床研究也显示出具有优良的疗效[3-8]。除此之外,LOXO-195和TPX-0005等以NTRK为靶点的在研药物也显示出强大的治疗潜力。
1.3 RET基因融合或激活变异
2018年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)大会报道了LIBRETTO-001Ⅰ期临床试验的结果,LOXO-292显示出对RET基因融合NSCLC患者高效的抗肿瘤活性,对脑转移患者也有一定的疗效。Ⅱ期临床试验正在进行中,计划入组RET融合的实体瘤患者、甲状腺髓样癌和其他具有RET变异的肿瘤患者。2018年WCLC大会上报道了该试验的更新数据,一共招募了38名患者,大部分治疗相关的不良事件为1级,ORR为68%,26名患者实现CR,8名患者疾病稳定,2名患者疾病进展。可测量的4例脑转移患者中,1名患者脑部病灶CR,3名患者PR[9]。
1.4 三代EGFR-TKI耐药机制探索
奥希替尼是目前中国已上市的唯一一个三代EGFR-TKI药物,对一代、二代EGFR-TKI耐药的患者和出现脑转移的患者有很好的疗效,但越来越多的中国患者已经出现了针对奥希替尼耐药的情况。耐药患者何去何从是在肺癌临床治疗中急需解决的重要问题。研究表明,奥希替尼耐药机制是最直观的优化临床治疗的方式,而奥希替尼耐药的主要原因可能有以下几点。
(1)EGFR基因出现二次突变,在奥希替尼耐药的患者中EGFRG796/C797突变占24.7%,EGFRL792突变占10.8%,EGFRL718/G719突变占9.7%。其中在体内或体外实验中均显示,L792和L718基因突变会导致奥希替尼耐药。
(2)下游致癌基因如MET、KRAS、PIK3CA等基因可能在奥希替尼治疗中出现获得性突变从而导致患者耐药[10]。奥希替尼耐药患者基因组图谱的分析显示,部分患者在耐药后表现为T790M突变丢失,部分患者保留T790M突变同时发生了新的突变,还有部分患者出现病理转变,从NSCLC转化为小细胞肺癌[11]。由此可见,患者进行定期的基因检测,监控基因突变的时空变化,对治疗效果的实时监控、优化治疗方案和延长生存时间非常必要。
1.5 新一代ALK抑制剂的临床应用
间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)重排的NSCLC患者使用克唑替尼、阿来替尼、布加替尼和色瑞替尼能够取得良好的疗效。2018年出现了一个这4种靶向药物耐药患者可用的高效ALK/ROS1小分子激酶抑制剂——劳拉替尼。2019年第2版美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)NSCLC治疗指南将劳拉替尼列为推荐用药,用于治疗经治后进展的ALK重排和ROS1重排的晚期NSCLC患者。劳拉替尼治疗初治患者的ORR能够到达90%,颅内缓解率达到60%,对既往接受过ALK-TKI患者的ORR达到47%,颅内缓解率为63%[12],已被FDA加速批准用于治疗ALK阳性和既往经过ALK-TKI治疗耐药的NSCLC患者。
2 液体活检
液体活检是一种微创液体检测的活检技术,极有可能改变癌症患者辅助诊疗疗效,用于患者的个体化分子图谱实时绘制的极为强大、可靠的非侵入性临床诊断工具。液体活检检测包括但不限于循环肿瘤细胞(circulating tumor cell,CTC)、循环肿瘤DNA(circulating tumor DNA,ctDNA)、循环肿瘤RNA(circulating RNA,ctRNA)、外泌体以及细胞外液体的某些物质,如脑脊液、胸腔积液和尿液[13]。在过去的20年里,这些不同类型的液体活检技术已经成功地应用于肿瘤学研究,这与超灵敏检测方法的发展密切相关。液体活检因“无创、即时、前瞻、灵敏”的优势备受瞩目,在临床和科研上均发挥着重要的作用。目前,液体活检ctDNA贯穿肿瘤精准诊疗全程,包括早期筛查、早期诊断、治疗疗效及预后预测、疗效监测、微小病灶残留检测、复发预测、耐药及耐药机制探索、肿瘤异质性及进化等[13-17]。此外,有文献报道,血液ctDNA检测是对TNM分期的补充,因此推荐用改良版分期系统,即TNMB分期系统,在TNM分期系统中增加液体活检信息“B”,针对“B”的初始分类定义未检测到(B0)或检测到(B1)ctDNA,基于ctDNA检测结果可获取预后和治疗信息[18]。随着证据的不断积累,该系统会进一步进行修订,以纳入不同部位具有临床意义的ctDNA量化界值。
2.1 最大规模的 ctDNA 研究彰显临床应用前景
美国Guardant Health公司发布了史上最大规模的ctDNA检测研究结果,Guardant 360平台检测了15191例患者的17628份血浆标本和398位患者的组织标本,结果表明,在83%患者的血液中能够检测到ctDNA,血检肿瘤DNA的敏感度分别能达到86%(肺癌),83%(乳腺癌),85%(结直肠癌)及78%(其他类型肿瘤)[19]。研究者对比了398例肿瘤组织和血浆ctDNA匹配的基因检测结果,血检结果对肿瘤的诊断准确率可高达87%(336/386),若血液检查和组织活检相差时间不超过6个月,其结果一致性可高达98%。在那些有动态血液监测的患者中,可检测到耐药突变(比如肺癌患者的EGFRT790M突变),而组织活检由于在接受治疗前进行检测,通常无法检测到耐药突变。
2.2 液体活检技术重复性与稳定性的争议
2017年12月28日发表于JAMA Oncology的一篇文章报道,Guardant Health与Personal Genome Diagnostics两家公司给同一批晚期前列腺癌患者做了液体活检,结果竟然大不相同,引发了对于液体活检技术重复性与稳定性的争议[20]。该文分析,检测结果不一致的可能因素有:①患者:数量少、低肿瘤负荷的队列;②Panel:非癌种针对性,特异性不高;③前列腺癌并非是液体活检应用的最佳癌种——不同瘤种间ctDNA突变检测阳性率的比较可知,前列腺癌几乎是所有实体瘤中(脑瘤以外)阳性率最低的癌种之一;④肿瘤负荷低,液体活检依赖于血浆cfDNA的浓度,与肿瘤负荷密切相关。低肿瘤负荷的队列,可能造成检出率过低;⑤检测平台差异性:实验环节、突变阈值或过滤机制不同。而就在此几个月前,JAMAOncology发表了一篇文章,9名不同的实体瘤患者在2个不同平台进行了组织与血液的NGS检测,血和组织的采样时间不同,结果显示:所有检出突变中仅有22%的突变在2个检测平台的结果是吻合的。与预期相符的是绝大部分不吻合的突变存在于突变丰度低于1%的血检突变位点上,而这部分突变位点可能更多地反映了存在异质性的肿瘤亚克隆[21]。总之,需要辩证看待液体活检。NGS液体活检想要大规模用于临床,不仅需要更加全面深入的验证,标准化检测体系的搭建,基于已建立标准的检测流程的多中心、大样本的有效性研究,还需加强对检测公司的监管力度,统一规范。
2.3 CAP 与 ASCO联合发布
ctDNA 检测指导意见 美国病理学家协会(College of American Pathologists, CAP)及 ASCO 专家组从 2007 ~ 2017 年发表的实体瘤 ctDNA 序列和拷贝数变异相关的 1 338篇文献中筛选分析了 390 篇文献,最后选择了 77篇进行汇总分析,认为目前血浆 ctDNA 在某些肿瘤类型的临床有效性和实用性有较好的证据支持,但在绝大多数晚期肿瘤中广泛临床应用的有效性和实用性有待更进一步证实 [22]。对于 ctDNA 临床有效性的评估结果显示,基于 PCR 方法的检测具有很高的特异性,但敏感性还有待提高, ctDNA 检测的阳性结果可以有效指导治疗,阴性结果还需要通过组织检测进行验证。除肺癌 EGFR 突变及结直肠癌 KRAS 突变,尚没有足够证据显示 ctDNA在其他变异类型或其他癌种中具有临床有效性。
目前,组织标本仍是临床上进行肿瘤基因检测的首选,但组织标本取材困难、处理复杂以及标本异质性等不足之处对临床实际应用产生了一定的局限性,就此而言,液体活检,尤其是 ctDNA 检测,是突破这些局限的优选替代方法。虽然现有的临床证据尚不足以完全支撑 ctDNA 在临床上的有效性及应用性,但已有证据证实,采用法规严格验证的ctDNA 检测结果可指导靶向治疗。这就要求我们在临床使用中需要使用合规的、具有明确临床有效性证据的 ctDNA 检测方法。
2.4 ctDNA 临床有效性的前瞻性证据
2018年10月11日,JAMA Oncology上发表的文章探讨了在真实世界的临床实践中,血浆NGS检测是否可改进突变检测和提高个体化治疗水平[23]。研究表明,在Ⅳ期NSCLC的常规诊疗中,结合血浆NGS检测可明显提高目标突变的检出数量,并可改善以此为指导的治疗。这项前瞻性队列研究中入选了323例转移性NSCLC的患者,他们按照常规临床诊疗接受了血浆检测。应用73-gene商业平台进行血浆NGS检测。在这323名NSCLC患者(女性占60.1%,中位年龄65岁)中,共计检出了113个(35.0%)治疗性目标突变(allele fraction,AF),包括EGFR、ALK、MET、BRCA1、ROS1、RET、ERBB2或BRAF。有94名(29.1%)患者因为主治医师决策或患者偏好而仅进行了血浆检测,其中31名(33.0%)患者检测出治疗性的AF,因此不再需要进行有创性的活检。在其余229名同时进行血浆和组织NGS检测或者无法进行组织NGS检测的患者中,有47名(20.5%)患者仅在组织中检出AF,而结合血浆检测后增加至82名(35.8%)。在根据血浆结果而接受靶向治疗的42名患者中,有36名(85.7%)达到PR/CR或者病情稳定。血浆检测得到的AF与按照实体瘤疗效评价标准得出的缓解情况无相关性(r=-0.121,P=0.45)。
2.5 ctDNA液体活检写进NCCN指南
2015年NSCLC血液EGFR基因突变检测中国专家共识和2016国际肺癌研究协会EGFR突变型晚期NSCLC管理共识均推荐,TKI耐药患者,组织活检先行、血液检测补充。2017年NCCN NSCLC指南(V6版)再次强调:TKI耐药患者应组织活检先行、血液检测补充。2017年CSCO原发性肺癌临床诊疗指南也推荐先行组织检测。而在2019年NCCN NSCLC指南(V1版)中,考虑到血检的敏感性和方便性,建议先进行血液基因检测,在血检阴性的情况下再推荐进行组织基因检测。此外,该指南中还提到了若没有组织标本可以使用液体活检代替,组织检测阴性再使用液体活检。这证实了血检的价值,同时也是血检从被质疑到被认可的一个过程。


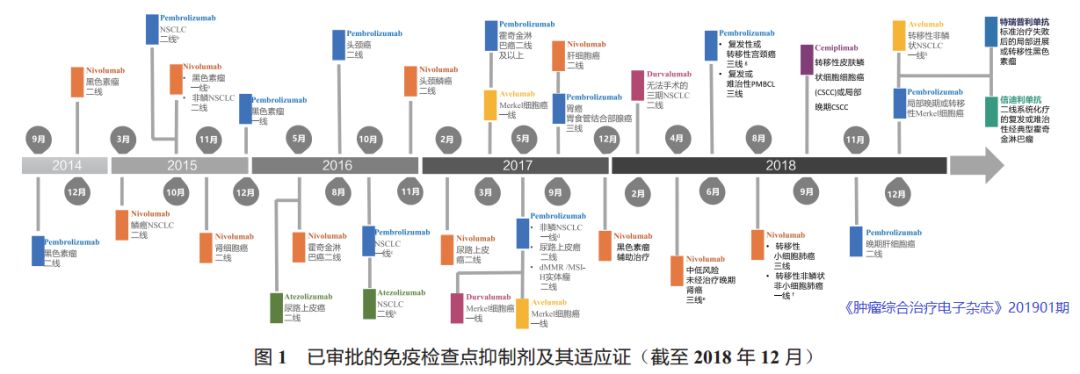
随着分子生物学和免疫学的发展,免疫治疗已成为恶性肿瘤一种新的治疗方式。免疫疗法的发展是癌症治疗的一个重要突破,其抗肿瘤疗效在多种癌种中都有体现[24]。多种免疫检查点抑制剂被批准上市(图1)。通过分子标志物筛选获益人群成为目前的主要临床策略,因此,基因检测相关的分子标志物有着重要的临床应用价值。包括NCCN指南在内的全球多部指南在2011年只推荐在肺癌进行EGFR和ALK单基因检测,到2016年,扩展了8个基因检测,到2017年加入了评估免疫治疗疗效的第一个分子标志物(biomarker)——PD-L1,2018年V3版结肠癌的NCCN指南增加了错配修复功能缺陷(deficient mismatch repair,dMMR)/高度微卫星不稳定(microsatellite instability-high,MSI-H)的实体瘤患者可以使用Nivolumab+Ipilimumab联合方案。2019年NCCNNSCLC指南(V1版)中新增了肿瘤突变负荷(tumor mutation burden,TMB)可作为指导初次双药联合(Nivolumab+伊匹木单抗)或单药(Nivolumab)免疫治疗NSCLC患者的独立生物标志物,并需要更大的基因组合(panel)进行检测[25]。随着TMB被写入NCCN指南,大panel的应用必将越来越广泛,与临床的联系也将越来越紧密。本文主要详细介绍免疫肿瘤(immune-oncology,I-O)治疗的biomarkers的最新进展,包括TMB、微卫星不稳定(micro satellite instability,MSI)、免疫相关正负向基因、ctDNA以及其他重要的biomarkers。
3.1 TMB
TMB指外显子区域上平均1Mb碱基出现的体细胞突变(非同义突变)数量。2014年,通过分析接受过CTLA-4抗体治疗癌症患者的全外显子测序(wholeexomesequencing,WES)数据,研究人员研究了TMB与治疗效果之间的关系,这也是首次在免疫治疗中评价TMB指标[26]。而真正将TMB作为免疫治疗疗效的biomarkers被大众熟知,是CheckMate026回顾性分析研究[27]。2017年,FoundationMedicine公司发布了接受FoundationOne(F1)检测的10万例患者数据分析[28]。研究表明,通过F1评估的TMB与WES准确率一致。同年,约翰•霍普金斯大学的ElizabethMarionJaffee教授在分析了多个临床研究数据之后提出,TMB对27种肿瘤类型的免疫治疗有显著的预测作用,TMB与ORR之间存在显著相关性(P<0.001),相关系数为0.74,这意味着在这27种肿瘤中,55%的ORR差异可以用TMB来解释,凸显了TMB与抗PD-1治疗疗效之间存在强相关性[29]。CheckMate227研究表明,在TMB≥10mut/Mb的晚期NSCLC患者中,与铂类双联化疗相比,Nivolumab联合Ipilimumab治疗明显延长了1年的无进展生存率(42.6%∶13.2%)。2018年美国癌症研究协会年会报道的CheckMate568研究表明,在接受Nivolumab联合Ipilimumab治疗的NSCLC患者,无论PD-L1表达水平如何,TMB≥10mut/Mb的患者中位无进展生存期几乎是TMB<10mut/Mb患者的3倍(7.1个月∶2.6个月)[30]。正是基于这些研究结果,TMB预测免疫治疗的疗效被写进了2018年NCCNNSCLC指南。目前TMB检测主要还是基于肿瘤组织,对于无法取得组织的患者,能否使用血液检测TMB用于免疫治疗疗效评估,还是一个探索方向。2018年NatMed上报道的一篇研究证实了bTMB对免疫治疗药物疗效预测的有效性[31]。2018年ESMO大会报道的B-FIRST研究是一项将血液TMB作为预测Atezolizumab单药一线治疗NSCLC疗效biomarker的前瞻性Ⅱ期研究[32],提示TMB时代正式拉开序幕,也让实时动态监测TMB成为可能。
尽管如此,TMB的临床应用仍面临一些问题,如有些TMB-H的患者对免疫治疗并没有达到预期的疗效,有些TMB低的患者使用免疫检查点抑制剂(immunecheckpointinhibitors,ICI)效果却很好。这意味着,除TMB之外,患者对免疫治疗的响应程度还与其他多种因素有关。此外,将TMB与其他标志物联合使用可能会提升TMB的预测能力,更多免疫治疗生物标志物的探索是临床亟待解决的问题。
3.2 MSI
MSI指由于在DNA复制时插入或缺失突变引起的短、重复DNA序列长度改变的现象,常由错配修复(mismatch repair,MMR)功能缺陷引起。MMR是重要的DNA修复机制,可识别和修复在DNA复制或重组过程中可能产生的碱基的错误插入、缺失和错配以及修复某些形式的DNA损伤的系统。一个国际多中心、开放性Ⅱ期研究CheckMate142评估了Nivolumab联合Ipilimumab治疗dMMR/MSI-H、转移性结直肠癌(metastatic colorectal cancer,mCRC)患者,ORR为54.6%(45.2%~63.8%),12周疾病控制率(diseasecontrolrate,DCR)为80%(71.5%~86.6%)[33]。基于此研究数据,2018年NCCN结肠癌指南(V3版)增加了dMMR/MSI-H的实体瘤患者可以使用Nivolumab+Ipilimumab方案。MSI的状态可以确定哪些患者可能受益于ICI,且适用于所有癌症类型。2018年发表在Cancer Med上的一篇文章,通过NGS方法检测了11348例患者的MSI状态[34]。其中,2189例患者(共26个癌症类型)进行PCR片段分析MSI(MSI-PCR),1986例患者进行了MMR-免疫组化与MSI-NGS进行比较。相比MSI-PCR分析,MSI-NGS敏感性为95.8%,特异性为99.4%,阳性预测值为94.5%,阴性的预测值为99.2%。研究表明,对于MSI的状态的评估,NGS平台比PCR敏感性更高,准确性更强,且MSI-H状态可以通过NGS跨癌症类型确定。CheckMate026回顾性分析研究涉及10万例病例,研究阐述了TMB、PD-1/PD-L1抑制剂、MSI以及遗传物质错误修饰等关键问题[27]。其中,TMB/MSI/MMR的相互关系可以理解为:MSI为TMB-H的子集,MSI-H的患者中,97%的患者TMB不小于10个突变/Mb,83%的患者不小于20个突变/Mb。但是,只有16%的TMB-H的患者是MSI。基于这些研究结果,综合评价这些biomarkers,而不是单一指标的分析,可以筛选出更多的免疫治疗优势人群,排除掉更多的免疫治疗劣势人群。
3.3 免疫相关正负向基因
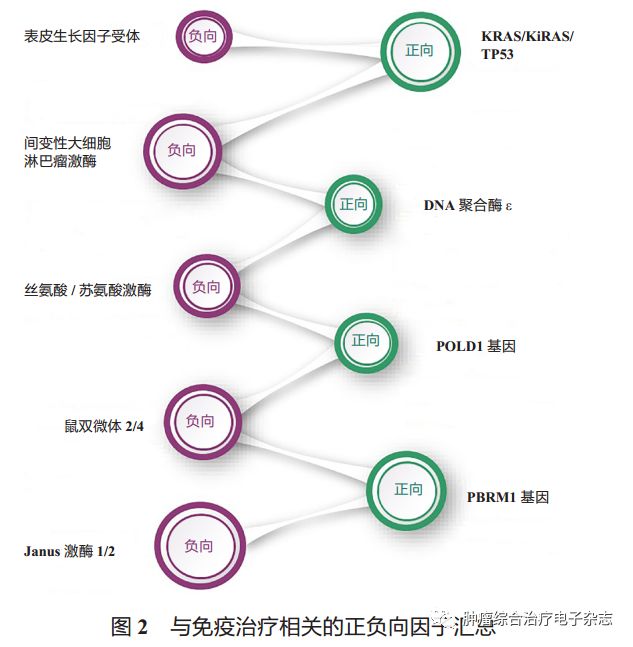
正向基因即与免疫治疗疗效正相关的基因,反之,负向基因是与免疫治疗疗效负相关的基因。目前在文献中提到的免疫治疗相关的正向因子有: KRAS、TP53、POLD1、POLE、PBRM1及DDR 相关基因等 ;负向因子有EGFR、ALK、STK11、MDM2、MDM4、JAK1及JAK2 等 [35-42](图 2)。
NGS 检测技术发展不仅可促进靶向治疗的发展,而且能够更快速、全面地评估免疫治疗疗效。用正向基因筛选 PD-1/PD-L1 抑制剂的优势人群需要更进一步的探索。用负向基因排除低效人群是一种新思路。
3.4 ctDNA 对免疫治疗的价值
2018年10月发表在Nat Rev Clin Oncol上的一篇综述总结了ctDNA在免疫治疗中的应用价值,主要包括以下几个方面[43]:①ctDNA可以检测微小残留灶(minimal residual disease,MRD),可用于指导最适ICI诊疗;②ctDNA可以无创检测错配修复缺陷和评估肿瘤突变负荷,这两种是预测ICI反应性的生物标志物;③监测接受ICI治疗的转移性癌症患者的ctDNA水平,可以在治疗过程中尽早确定治疗效果,避免长期无效治疗;④在ctDNA中可以检测到可能预测ICI耐药性的突变。目前,设计用于验证“接受Pembrolizumab治疗的患者ctDNA水平降低”假设的第一个试验(NCT03145961)现已开始。该研究密切关注无病生存和总生存的数据,这种方法可能延迟(甚至预防)疾病复发。另外,研究发现ctDNA检测后的某些基因突变与ICI的疗效有关。其中,CTNNB1基因中的PTEN缺失和活化突变或功能丧失突变是黑色素瘤患者ICI耐药的标志,与肿瘤部位T细胞浸润减少有关[44,45]。Hugo等[46]在接受抗PD-1抗体的黑色素瘤患者中,报道在对治疗有反应的患者中更常见到BRCA2突变。在高级别浆液性卵巢癌患者中,与BRCA-野生型肿瘤相比,BRCA突变肿瘤具有较高的TMB和预测的肿瘤新抗原负荷(tumor neo-antigen burden,TNB),上皮内和肿瘤周围免疫细胞表达PD-1和PD-L1水平也较高,这表明对ICI的反应性更好。综上所述,开发ctDNA中同源重组缺陷的评估技术,评估参与同源重组缺陷的基因中的功能丧失突变对临床有帮助。但是要全面论证ctDNA对临床应用的价值还需要更多的临床研究。
3.5 其他
2013年,Daniel Chen和Ira Mellman将肿瘤免疫循环分为7个步骤,包括肿瘤抗原的释放、肿瘤抗原的呈递、T细胞的激活与分化、T细胞的迁移、T细胞浸润、识别肿瘤细胞、杀死肿瘤细胞[47],肿瘤免疫周期的每一步都需要协调多种因素,包括刺激因素和抑制因素,使免疫系统的活化保持在正常范围之内。目前,关于ICI疗效的biomarkers已经有很多临床数据积累。其中,PD-L1、TMB及dMMR/MSI-H已经写入NCCN指南。除此之外,如HLA-Ⅰ类分子、TNB、免疫微环境及免疫分型等,具有潜力的biomarkers的研究正在进行中。怎样筛选出使用PD-1/PD-L1抑制剂治疗疗效好的患者,排除掉疗效不好的患者,是免疫治疗中的重要问题。目前ICI相关的临床研究,趋于多组学、多维评估的方式来预测免疫治疗的临床疗效和预后。


2018 年,肿瘤治疗已经进入了精准和综合治疗时代,各种检测手段辅助医师诊疗分析为患者制定最优的治疗方案,并实现动态监控。随着检测技术、生物标记物研究以及新型药物研发等方面的推进,真正实现患者的个性化诊疗指日可待。
[2] Cocco E, Scaltriti M, Drilon A. NTRK fusion-positive cancers and TRK inhibitor therapy[J]. Nat Rev Clin Oncol, 2018,15(12):731-747.
[3] Ulrik L, Catherine MA, et al. Larotrectinib efficacy and safety in TRK fusion cancer: an expanded clinical dataset showing consistency in an age and tumor agnostic approach[Z]. Messe Munich: ESMO, 2018.
[4] Robert CD, Myung JA, Salvatore Siena, et al. Efficacy and
Safety of Entrectinib in Locally Advanced or Metastatic ROS1-Positive Non-Small Cell Lung Cancer (NSCLC)[Z/OL]. [2019-01-25].https://www.roche.com/dam/jcr:3f940849-6f73-4151-8108-f14254040c5e/en/WCLC_Entrectinib_ROS1.pdf.
[5] Drilon A, Siena S, Ou SI, et al. Safety and Antitumor Activity of the Multitargeted Pan-TRK, ROS1, and ALK Inhibitor Entrectinib: Combined Results from Two Phase Ⅰ Trials (ALKA-372-001 and STARTRK-1)[J]. Cancer Discov, 2017, 7(4):400-409.
[6] Smith KM, Fagan PC, Pomari E, et al. Antitumor Activity of Entrectinib, a Pan-TRK, ROS1, and ALK Inhibitor, in ETV6-NTRK3-Positive Acute Myeloid Leukemia[J]. Mol Cancer Ther, 2018, 17(2):455-463.
[7] Landman Y, Ilouze M, Wein S, et al. Rapid Response to Larotrectinib (LOXO-101) in an Adult Chemotherapy-Naive Patients With Advanced Triple-Negative Secretory Breast Cancer Expressing ETV6-NTRK3 Fusion[J]. Clin Breast Cancer, 2018,18(3):e267-e270.
[8] Berger S, Martens UM, Bochum S. Larotrectinib (LOXO-101)[J]. Recent Result Cancer Res, 2018, 211:141-151.
[9] Geoffrey RO, Vivek S, Keunchil P, et al. Clinical activity of LOXO292, a Highly selective RET inhibitor, in patients with ret fusion + Non-small cell lung cancer[Z/OL]. [2019-01-25].https:// www.loxooncology.com/docs/presentations/WCLC_2018-LOXO292.PDF.
[10] Yang Z, Yang N, Ou Q , et al. Investigating Novel Resistance Mechanisms to Third-Generation EGFR Tyrosine Kinase
Inhibitor Osimertinib in Non-Small Cell Lung Cancer Patients[J]. Clin Cancer Res, 2018, 24(13):3097-3107.
[11] Oxnard GR, Hu Y, Mileham KF, et al. Assessment of Resistance Mechanisms and Clinical Implications in Patients With EGFR T790M-Positive Lung Cancer and Acquired Resistance to Osimertinib[J]. JAMA Oncol, 2018, 4(11):1527-1534.
[12] Solomon BJ, Besse B, Bauer TM , et al. Lorlatinib in patients with ALK-positive non-small-cell lung cancer: results from a global phase 2 study[J]. Lancet Oncol, 2018, 19(12):1645-1667.
[13] Lianidou E, Pantel K. Liquid Biopsies[J]. Genes Chromosomes Cancer, 2018. [Epub ahead of print]
[14] Santarpia M, Liguori A, D'Aveni A, et al. Liquid biopsy for lung cancer early detection[J]. J Thorac Dis, 2018, 10(Suppl 7):S882-S897.
[15] Siravegna G, Marsoni S, Siena S, et al. Integrating liquid biopsies into the management of cancer[J]. Nat Rev Clin Oncol,2017, 14(9):531-548.
[16] Cabel L, Proudhon C, Mariani P, et al. Circulating tumor cells and circulating tumor DNA: What surgical oncologists need to know[J]. Eur J Surg Oncol, 2017, 43(5):949-962.
[17] Corcoran RB, Chabner BA. Application of Cell-free DNA Analysis to Cancer Treatment[J]. N Engl J Med, 2018,379(18):1754-1765.
[18] Yang M, Forbes ME, Bitting RL, et al. Incorporating blood-based liquid biopsy information into cancer staging: time for a TNMB system[J]. Ann Oncol, 2018, 29(2):311-323.
[19] Odegaard JI, Vincent JJ, Mortimer S, et al. Validation of a Plasma-Based Comprehensive Cancer Genotyping Assay
Utilizing Orthogonal Tissue- and Plasma-Based Method ologies[J]. Clin Cancer Res, 2018, 24(15):3539-3549.
[20] Torga G, Pienta KJ. Patient-Paired Sample Congruence Between 2 Commercial Liquid Biopsy Tests[J]. JAMA Oncol, 2018, 4(6):868-870.
[21] Kuderer NM, Burton KA, Blau S, et al. Comparison of 2 Commercially Available Next-Generation Sequencing Platforms in Oncology[J]. JAMA Oncol, 2017, 3(7):996-998.
[22] Merker JD, Oxnard GR, Compton C, et al. Circulating Tumor DNA Analysis in Patients With Cancer: American Society of Clinical Oncology and College of American Pathologists Joint Review[J]. J Clin Oncol, 2018, 36(16):1631-1641.
[23] Aggarwal C, Thompson JC, Black TA, et al. Clinical Implications of Plasma-Based Genotyping With the Delivery of Personalized Therapy in Metastatic Non-Small Cell Lung Cancer[J]. JAMA Oncol, 2018. [Epub ahead of print]
[24] Mehnert JM, Monjazeb AM, Beerthuijzen JMT, et al. The Challenge for Development of Valuable Immuno-oncology Biomarkers[J]. Clin Cancer Res, 2017, 23(17):4970-4979.
[25] David SE, Douglas EW, Dara LA,et al. NCCN Clinical Practice Guidelines in Oncology : Non-Small Cell Lung Cancer (Version 1.2019)[Z/OL]. [2019-01-25]. http://guide.medlive.cn/guideline/16693.
[26] Snyder A, Makarov V, Merghoub T, et al. Genetic Basis for Clinical Response to CTLA-4 Blockade in Melanoma[J]. N Engl J Med, 2014, 371(23): 2189-2199.
[27] Carbone DP, Reck M, Paz-Ares L, et al. First-Line Nivolumab in Stage Ⅳ or Recurrent Non-Small-Cell Lung Cancer[J]. N Engl J Med, 2017, 376(25):2415-2426.
[28] Chalmers ZR, Connelly CF, Fabrizio D, et al. Analysis of 100,000 human cancer genomes reveals the landscape of tumormutational burden[J]. Genome Med, 2017, 9(1):34.
[29] Yarchoan M, Hopkins A, Jaffee EM. Tumor Mutational Burden and Response Rate to PD-1 Inhibition[J]. N Engl J Med, 2017,377(25): 2500-2501.
[30] Suresh SR, Matthew DH, Mark MA, et al. Tumor Mutational Burden (TMB) as a Biomarker for Clinical Benefit From Dual Immune Checkpoint Blockade With Nivolumab + Ipilimumab in First-line Non-Small Cell Lung Cancer: Identification of TMB Cutoff From CheckMate 568[J]. AACR Cancer Res, 2018, 78(13 Suppl):Abstract nr CT078.
[31] Gandara DR, Paul SM, Kowanetz M, et al. Blood-based tumor mutational burden as a predictor of clinical benefit in nonsmall-cell lung cancer patients treated with Atezolizumab[J]. Nat Med, 2018, 24(9): 1441.
[32] Kim ES, Velcheti V, Mekhail T, et al. Primary efficacy results from B-FIRST, a prospective Phase Ⅱ trial evaluating bloodbased tumour mutational burden (bTMB) as a predictive biomarker for atezolizumab (atezo) in 1L non-small cell lung cancer (NSCLC)[Z/OL]. [2019-01-12]. https://oncologypro.esmo.org/Meeting-Resources/ESMO-2018-Congress/Primaryefficacy-results-from-B-F1RST-a-prospective-Phase- Ⅱ-trialevaluating-blood-based-tumour-mutational-burden-bTMB-as-apredictive-biomarker-for-atezolizumab-atezo-in-1L-non-smallcell-lung-cancer-NSCLC.
[33] Overman MJ, McDermott R, Leach JL, et al. Nivolumab in patients with metastatic DNA mismatch repair-deficient or microsatellite instability-high colorectal cancer (CheckMate 142): an open-label, multicentre, phase 2 study[J]. Lancet Oncol, 2017, 18(9):1182-1191.
[34] Vanderwalde A, Spetzler D, Xiao N, et al. Microsatellite instability status determined by next-generation sequencing and compared with PD-L1 and tumor mutational burden in 11,348 patients[J]. Cancer Med, 2018, 7(3):746-756.
[35] Patel SJ, Sanjana NE, Kishton RJ, et al. Identification of essential genes for cancer immunotherapy[J]. Nature, 2017, 548(7669):537-542.
[36] Rizvi H, Sanchez-Vega F, La K, et al. Molecular Determinants of Response to Anti-Programmed Cell Death (PD)-1 and AntiProgrammed Death-Ligand 1 (PD-L1) Blockade in Patients With Non-Small-Cell Lung Cancer Profiled With Targeted NextGeneration Sequencing[J]. J Clin Oncol, 2018, 36(7):633-641.
[37] Rizvi NA, Hellmann MD, Snyder, et al. Cancer immunology.Mutational landscape determines sensitivity to PD-1 blockade in non-small cell lung cancer[J]. Science, 2015, 348(6230):124-128.
[38] Teo MY, Seier K, Ostrovnaya I, et al. Alterations in DNA Damage Response and Repair Genes as Potential Marker of Clinical Benefit From PD-1/PD-L1 Blockade in Advanced Urothelial Cancers[J]. J Clin Oncol, 2018, 36(17):1685-1694.
[39] Miao D, Margolis CA, Gao W, et al. Genomic correlates of response to immune checkpoint therapies in clear cell renal cell carcinoma[J]. Science, 2018, 359(6377):801-806.
[40] Oshima Y, Tanimoto T, Yuji K, et al. EGFR-TKI-Associated Interstitial Pneumonitis in Nivolumab-Treated Patients With Non-Small Cell Lung Cancer[J]. JAMA Oncol, 2018,4(8):1112-1115.
[41] Spigel DR, Reynolds C, Waterhouse D, et al. Phase 1/2 Study of the Safety and Tolerability of Nivolumab Plus Crizotinib for the First-Line Treatment of Anaplastic Lymphoma Kinase Transl ocation - Positive Advanced Non-Small Cell Lung Cancer (CheckMate 370)[J]. J Thorac Oncol, 2018, 13(5):682-688.
[42] Budczies J, Bockmayr M, Klauschen F, et al. Mutation patterns in genes encoding interferon signaling and antigen presentation:A pan-cancer survey with implications for the use of immune checkpoint inhibitors[J]. Genes Chromosomes Cancer, 2017,56(8):651-659.
[43] Cabel L, Proudhon C, Romano E, et al. Clinical potential of circulating tumour DNA in patients receiving anticancer immunotherapy[J]. Nat Rev Clin Oncol, 2018, 15(10):639-650.
[44] George S, Miao D, Demetri GD, et al. Loss of PTEN is associated with resistance to anti-PD-1 checkpoint blockade therapy in metastatic uterine leiomyosarcoma[J]. Immunity, 2017, 46(2):197-204.
[45] Peng W, Chen JQ, Liu C, et al. Loss of PTEN promotes resistance to T cell-mediated immunotherapy[J]. Cancer Discov, 2016, 6(2):202-216.
[46] Hugo W, Zaretsky JM, Sun L, et al. Genomic and Transcr iptomic Features of Response to Anti-PD-1 Therapy in Metastatic Melanoma[J]. Cell, 2016, 165(1):35-44.
[47] Chen DS, Mellman I. Oncology meets immunology: the cancerimmunity cycle[J]. Immunity, 2013, 39(1):1-10.
来源:肿瘤综合治疗电子杂志