- A+
▎药明康德内容团队报道
伏美替尼是第三代表皮生长因子受体(EGFR)激酶抑制剂。EGFR是一组具有酪氨酸激酶活性的表皮生长因子家族的细胞表面受体,其活化后会激活包括PI3K-Akt、MAPK-Erk等在内的下游多条信号传导通路,产生细胞增殖效应。EGFR活化异常可激活与肿瘤增殖、分化相关的基因,继而诱发肿瘤的形成和发展。EGFR抑制剂通过与内源性配体竞争结合EGFR,抑制酪氨酸激酶的活化,阻断EGFR信号通路,从而产生抑制肿瘤细胞的增殖、转移并促进肿瘤细胞发生凋亡等一系列生物学效应。
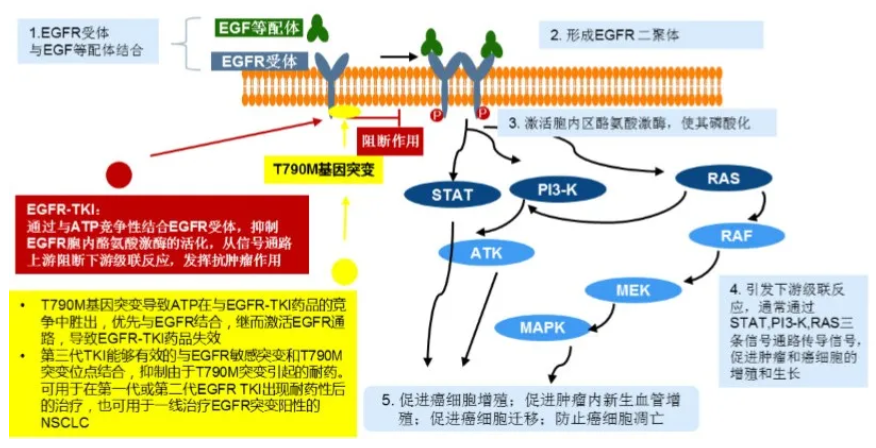 ▲EGFR抑制剂作用原理 (截图来源:参考资料[2])
▲EGFR抑制剂作用原理 (截图来源:参考资料[2])
据艾力斯医药首席执行官牟艳萍女士在采访中介绍,作为第三代EGFR-TKI,伏美替尼的独特性体现在四个方面:第一是具有双活性的差异化特征,主要活性代谢产物AST5902与原型药AST2818均可强效抑制EGFR敏感突变和T790M耐药突变;第二是高选择性,即只对EGFR敏感突变起作用,对野生型几乎无抑制作用;第三是安全,即与药物相关的严重不良反应少,在伏美替尼的注册临床研究中,各项≥3级可能的药物相关不良反应发生率均<1.5%;第四是强效缩瘤,伏美替尼的疗效在2a和2b期多中心、单臂临床试验中得以验证。
根据公开信息,截至2020年1月29日,伏美替尼对EGFR T790M突变阳性的局部晚期或转移性NSCLC患者治疗的客观缓解率(ORR)达74.1%。这意味着伏美替尼对74.1%的病人是有效的(有效的判断标准为肿瘤缩小30%及以上)。研究中,治疗组疾病控制率(DCR)为93.6%,临床获益率(CBR)为79.5%,中位无进展生存期(mPFS)为9.6个月,中位缓解持续时间(mDOR)为8.3个月。伏美替尼本次获批上市将为非小细胞性肺癌(NSCLC)成人患者提供了新的治疗选择。
除了针对NSCLC二线治疗,伏美替尼针对EGFR敏感突变晚期NSCLC一线治疗适应症的3期临床试验已于2019年6月启动,预计2022年提交上市申请。此外,艾力斯医药还将持续拓展伏美替尼的临床应用,包括联合疗法、术后辅助治疗等。
祝贺上海艾力斯医药伏美替尼正式在中国获批上市,希望这款创新药能够尽快惠及NSCLC患者。
参考资料
[1] 国家药监局官网https://www.nmpa.gov.cn/yaowen/ypjgyw/20210303144734196.html
本篇文章来源于微信公众号: 即刻药闻