- A+
关于近期燃石在CFDA注册通过的4基因NGS基因突变检测产品,在网络上沸沸扬扬,这是国内第一个成功注册的NGS基因检测产品,具有里程碑意义。下面我们通过评审报告来了解一下CFDA的评审过程,顺便了解一下NGS基因检测产品的准确性。
体外诊断试剂产品注册技术审评报告
受理号: CSZ1700157
产品中文名称:人EGFR/ALK/BRAF/KRAS 基因突变联合检测试剂盒(可逆末端终止测序法)
产品管理类别:三类 6840
申请人名称 :广州燃石医学检验所有限公司
产品审评摘要
一、产品概述
二、临床前研究摘要
三、临床评价摘要
四、风险分析及说明书提示
综合评价意见
三、生产地址
广州国际生物岛螺旋四路7号3栋第二层202房;广州国际生物岛螺旋四路7号3栋第六层601房。
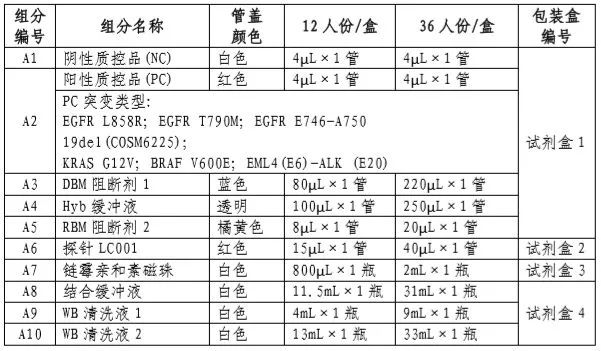 试剂盒具体组成成分及配套试剂及软件见说明书。
试剂盒具体组成成分及配套试剂及软件见说明书。
(二)产品预期用途
本试剂盒用于定性检测非小细胞肺Ca(NSCLC)患者经福尔马林固定的石蜡包埋(FFPE)的组织标本中EGFR/ALK/BRAF/KRAS基因变异。其中,EGFR基因中:19号外显子缺失(19del)、L858R点突变用于吉非替尼片、盐酸埃克替尼片伴随诊断检测,T790M点突变用于甲磺酸奥希替尼片的伴随诊断检测;ALK基因中:ALK重排(融合)用于克唑替尼胶囊的伴随诊断检测(具体可参照表2)。
表2伴随诊断用途的基因变异类型及相应的靶向药物
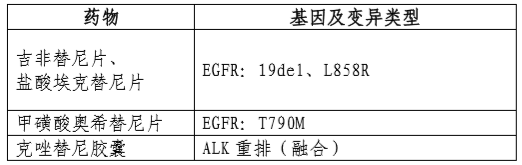
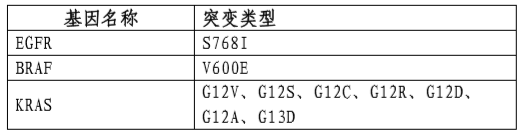
表3中为本试剂盒可以检出,但未经伴随诊断验证的基因突变类型。
表3未经伴随诊断验证的基因突变类型
其检测结果仅供临床参考,不应作为患者个体化治疗的唯一依据。临床医生应结合患者病情及其他实验室检测指标等因素对检测结果进行综合判断。
(三)产品包装规格
12人份/盒;36人份/盒。
(四)产品检验原理
该试剂盒采用RNA探针捕获技术,首先对从FFPE样本中提取的组织DNA进行片段化、加接头、及PCR富集等步骤制备预文库;其后采用具有特定序列的RNA探针与预文库进行杂交,从而特异性地捕获来自人类基因组4种基因中的部分外显子与内含子区域;之后通过磁珠法富集被探针捕获的DNA药物基因及变异类型吉非替尼片、盐酸埃克替尼片EGFR:19del、L858R甲磺酸奥希替尼片EGFR:T790M克唑替尼胶囊ALK重排(融合)基因名称突变类型EGFRS768IBRAFV600EKRASG12V、G12S、G12C、G12R、G12D、G12A、G13D片段,并对捕获的文库进行定量与质控;最后将经定量的文库采用基因测序仪(型号:MiSeqDx,Illumina公司生产)进行高通量测序。采用生物信息学软件判读4种靶基因中是否存在来自肿瘤的变异。
二、临床前研究摘要
(一)主要原材料
1.主要原材料的选择
该试剂盒主要原材料包括:探针、链霉亲和素磁珠,阴性质控品(NC)、阳性质控品(PC),这些原材料均为外购方式获得,探针为申请人自行设计后由专业的合成公司合成。申请人选择有资质的供应商提供的原料,通过功能性试验,筛选出最佳原材料和供应商。制定了各主要原材料质量标准并经检验合格。
2.企业参考品和质控品设置情况
企业参考品包括阴性参考品、阳性参考品、重复性参考品和最低检出限参考品。阴性参考品包括EGFR/ALK/BRAF/KRAS基因变异阴性的正常组织样本、试剂检测范围内EGFR/ALK/BRAF/KRAS基因变异阴性且其它基因变异阳性(PTEN、PIK3CA、TP53基因变异阳性)的肺Ca组织样本和细胞系样本,阳性参考品、重复性参考品和最低检出限参考品采用临床EGFR/ALK/BRAF/KRAS基因变异阳性的肺Ca组织样本和细胞系样本。
阴性参考品共13份,包括7份EGFR/ALK/BRAF/KRAS基因变异阴性的正常肺组织样本或细胞系样本、6份试剂检测范围内EGFR/ALK/BRAF/KRAS基因变异阴性且其它基因变异阳性的组织样本或细胞系样本。所有阴性参考品经数字PCR和Sanger测序法验证。
阳性参考品涵盖了每种突变类型,共15份,为临床EGFR/ALK/BRAF/KRAS基因变异阳性肺Ca组织样本或阳性细胞系样本。所有阳性参考品基因变异类型经数字PCR和Sanger测序法验证。
最低检出限参考品涵盖每种突变类型,共9份,由阳性细胞系样本或者经病理诊断为阳性的肺Ca组织样本制备,包含2%的EGFR/BRAF/KRAS基因突变比例和10%ALK基因重排(融合)突变比例的最低检出限参考品。最低检出限参考品采用数字PCR进行基因变异类型确认及突变比例的确定。
重复性参考品涵盖每种突变类型,共5份,为临床EGFR/ALK/BRAF/KRAS基因变异阳性肺Ca组织样本或阳性细胞系样本,突变类型突变比例为10%,重排(融合)类型变异比例为30%。所有重复性参考品的基因变异类型均经数字PCR验证。
本试剂盒设置了阴性质控品(NC)和阳性质控品(PC),其中,阴性质控品(NC)为人正常肺上皮细胞系提取的DNA样本,阳性质控品(PC)涵盖每种突变类型,为EGFR/ALK/BRAF/KRAS基因变异阳性细胞系提取的DNA样本,用于检测过程中试剂和仪器的质量控制。阴性质控品(NC)和阳性质控品(PC)的基因变异情况均经数字PCR验证。
(二)生产工艺及反应体系研究
申请人通过对试剂主要生产工艺的研究,确定了最佳生产工艺。
申请人通过使用初步确定的配方进行反应体系配制,对反应体系中的样本核酸提取试剂、加样量、片段化酶的酶切反应时间、片段化酶用量、纯化磁珠用量、接头连接程序、杂交探针用量、杂交反应时间、乙醇配制比例和放置时间、扩增反应条件等进行筛选和优化,通过企业参考品或临床样本进行功能性试验,最终确定了最佳的反应体系。
(三)分析性能评估
本产品分析性能评估内容包括重复性试验、最低检出限试验、阴/阳性参考品符合率评估、分析特异性研究(干扰因素和交叉反应)、核酸提取试剂等配套试剂盒的组合性能研究、肿瘤组织样本要求研究、不同规格试剂盒的分析性能验证等。
在重复性试验中,申请人采用重复性参考品在3批成品试剂盒(201604001、201604002、201604003)上分别完成10次重复检测,检测结果一致;同时选取了重复性参考品中未包含,但在试剂盒检测范围内的基因突变或重排(融合)的临床阳性样本18份(来自有资质的临床机构,所有阳性样本的基因变异类型均经数字PCR验证)在3批成品试剂盒上分别完成10次重复检测,检测结果一致;结果表明试剂盒重复性良好。
在最低检出限试验中,申请人选择9份带有已知突变(经数字PCR验证为EGFR/ALK/BRAF/KRAS基因变异阳性)的临床阳性样本和1份无突变的临床阴性样本(经数字PCR验证),根据样本的原始突变比例,按照不同比例稀释成点突变10%、5%、2%和1%及重排(融合)30%、20%、10%和5%的样本,分别使用3批试剂盒,每个样本重复检测,依据该梯度研究结果,对于点突变、缺失突变,检测限确认为2%,重排(融合)的检测限确认为10%;用3批成品试剂盒(201604001、201604002、201604003)进行9份最低检出限参考品的检测,每个样本重复检测,结果均能正确检出;同时配制了最低检出限参考品中未包含,但在试剂盒检测范围内的基因突变或重排(融合)的18份最低检出限验证样本(临床阳性样本来自有资质的临床机构,其基因变异类型均经数字PCR验证)在3批成品试剂盒上分别完成重复检测,结果均能正确检出。最终确定该产品能够检测出50ngDNA样本中突变比例低至2%的EGFR/BRAF/KRAS基因突变和突变比例低至10%的ALK基因重排(融合)突变。
本试剂盒采用15份阳性参考品和13份阴性参考品在3批成品试剂盒(201604001、201604002、201604003)上分别评价了试剂盒的阳性参考品符合率和阴性参考品符合率,符合率均为100%。同时选取了阳性参考品中未包含,但在试剂盒检测范围内的基因突变或重排(融合)的临床阳性样本18份(来自有资质的临床机构,所有阳性样本的基因变异类型均经数字PCR验证)在3批成品试剂盒上分别进行检测,结果均能正确检出。干扰因素研究结果显示临床组织样本中可能存在的内源性干扰物(人总蛋白,浓度为400ng/uL),以及外源性干扰物(乙醇、福尔马林、石蜡等,浓度分别为1%v/v、0.006%v/v和1%v/v),均不干扰本试剂盒的检测结果。针对坏死组织对检测结果的影响进行研究,结果显示组织样本中坏死组织占比对样本检测结果无直接影响
交叉反应研究包括与检测范围内的基因核酸序列相近或具有同源性、易引起交叉反应的野生型或其他突变类型序列的交叉反应,不同基因序列之间的交叉反应以及肺相关感染微生物的交叉反应研究。所用样本包括PTEN基因阳性细胞系样本、PIK3CA基因阳性细胞系样本、TP53基因阳性细胞系样本、EGFR同源基因阳性组织样本、KRAS同源阳性细胞系样本、BRAF同源基因阳性组织样本、金黄色葡萄球菌/大肠杆菌/白色念珠菌DNA,经验证,上述样本与该产品均不产生交叉反应。
核酸提取试剂等配套试剂盒的组合性能研究。该产品检测全过程中需配套各种检测的试剂,申请人对配套试剂组合性能进行了研究,针对可配套使用的3种核酸提取试剂、2种测序试剂,进行交叉实验。经验证,该产品与配套试剂配合使用的检测结果均符合要求,不同组合检测结果均符合要求。
肿瘤组织样本要求的研究中,申请人对不同肿瘤细胞占比对检测结果的影响进行了研究。结果表明,肿瘤细胞占比10%以上的组织样本可以全部检出。结合临床样本的多样性和复杂性,建议组织样本肿瘤细胞占比≥20%。
两种规格试剂盒的分析性能验证。申请人用企业参考品对12人份/盒、36人份/盒两种规格试剂盒进行了阴性参考品符合率、阳性参考品符合率、重复性、最低检出限的评估,结果符合产品技术要求的规定。
申请人提供了五批产品(12人份/盒:201603001,36人份/盒:201603001、201604001、201604002、201604003)在其适用机型上的性能评估资料,结果均符合要求。
(四)阳性判断值
本产品用于阳性判断值确认的组织样本来源于临床医院,样本经数字PCR方法验证。
阳性判断值确定:申请人共采用了54个样本进行检测,对于54个样本分别统计其EGFR/ALK/BRAF/KRAS基因变异位点具有双端支持(即正向和反向序列支持)的独特(即去除PCR重复)DNA片段的情况。通过已知阳性位点具有的数据统计和已知阴性位点的数据统计,来确定最合适的阴/阳性判断的标准并且使用Fisher精确检验,对使用2条具有双端支持(即正向和反向序列支持)的独特(即去除PCR重复)DNA片段区别阴阳的能力进行显著性差异检验。将上述样本阴/阳性判断结果对应的具有双端支持(即正向和反向序列支持)的独特(即去除PCR重复)DNA片段的数量进行统计分析计算,结果显示,当检出突变的双端支持(即正向和反向序列支持)的独特(即去除PCR重复)DNA片段≥2时,能够100%正确区分阳性和阴性结果并且具有非常显著的统计学差异,表明当检出突变的双端支持(即正向和反向序列支持)的独特(即去除PCR重复)DNA片段≥2时,能够正确区分阳性和阴性结果。
阳性判断值验证:用临床组织样本或者细胞系样本构建EGFR/ALK/BRAF/KRAS基因变异阳性(具有临床用药指导意义的位点,包括SNV、INDEL和fusion)或阴性的参考品进行检测,共获得107个样本原始数据,分别测试阳性符合率、阴性符合率、重复性,最低检出限。结果表明,阳性符合率、阴性符合率、重复性、最低检出限都100%吻合,总体验证结果符合要求。
综合以上研究确认,本产品的阳性判断标准为:经过燃石数据分析流程(数据分析流程见说明书)处理后,符合质量指标要求的突变结果进行阴/阳性判断。如突变的双端支持(即正向和反向序列支持)的独特(即去除PCR重复)DNA片段≥2时,判断为阳性;反之,则判断为阴性。
(五)稳定性
申请人对该产品实时稳定性、运输稳定性、冻融稳定性、开瓶稳定性进行了研究,确定了在各种条件下本产品的有效保存时间。
同时对石蜡样本稳定性、核酸(DNA)溶液稳定性、文库稳定性等进行了研究,确定了检测过程中各种样本类型的有效保存时间。实时稳定性研究:采用三批次试剂盒(批号:00020141102、00020141103、00020141201)储存于试剂盒标示储存条件下分别在0、3月、6月、9月、12月和15月对物理性能、准确度等进行考察,各项性能指标均符合要求,确定产品标示保存条件为:试剂盒1(-25℃~15℃)、试剂盒2(-85℃~70℃)、试剂盒3(2℃~8℃)、试剂盒4(常温:10℃~30℃),可稳定保存12个月。
运输稳定性研究:申请人对试剂的运输稳定性进行研究,采用三批试剂盒(批号:00020141102、00020141103、00020141201)分别在模拟极限运输温度条件下放置7天后进行实时稳定性考察,各项性能指标均符合要求;另外选取适量试剂盒在规定运输方式下运输5天后,对物理性能、准确度等进行考察,各项性能指标均符合要求。确定了该产品的运输条件。
冻融稳定性研究:将三批次成品试剂盒(批号:00020150901、00020150902、00020150903)反复冻融数次,分别在反复冻融第0,1,3,5,7,8,9次后对物理性能、准确度等进行考察,结果均无影响。为保证检测结果的稳定性,推荐使用过程中试剂尽量避免反复冻融,并且冻融次数最多不超过6次。
开瓶稳定性研究:将三批次成品试剂盒(批号:201604001、201604002、201604003)在储存前进行开瓶;同时设立正常温度储存未开瓶的(0个月)的试剂盒,作为本次研究的对照组;将实验组的3批试剂分别模拟使用,开瓶2小时,然后按照储存条件放置,分别在相应的节点时间进行检测,检测项目包括:外观、阳性参考品符合率、阴性参考品符合率、重复性、最低检出限检验。结果显示,开瓶后的试剂盒在试剂盒标示储存条件下保存12个月,各项性能指标均满足要求。申请人对石蜡样本稳定性、核酸(DNA)溶液稳定性、文库稳定性等进行了研究。研究确认石蜡组织样本保存年限应不超过2年;核酸(DNA)溶液-20℃或-80℃可以保存5年;为保证检测结果的稳定性,建议提取的DNA保存时间不超过6个月,同时尽量避免文库的反复冻融,次数不得超过4次。
三、临床评价摘要
(一)比较研究
申请人在四川大学华西医院、上海市胸科医院、中国医学科学院肿瘤医院、复旦大学附属肿瘤医院、上海市肺科医院共5家临床试验机构完成了临床试验。采用考核试剂与已上市产品对临床样本进行比较研究的方法,验证本产品的临床性能。入组样本为非小细胞肺Ca样本1334例(主要是腺肿瘤和少部分鳞肿瘤、腺鳞肿瘤等)和干扰样本126例(主要包括良性肿瘤和小细胞肿瘤),样本类型为石蜡包埋组织,共计1460例。对比方法选择已上市产品:ALK基因重组检测试剂盒(荧光原位杂交法)(注册证号:国械注进20143405183)、人类EGFR基因突变检测试剂盒(荧光PCR法)(注册证号:国食药监械(准)字2014第3400973号)、人BRAF基因突变检测试剂盒(荧光PCR法)(注册证号:国食药监械(准)字2014第3401045号)、人KRAS基因突变检测试剂盒(荧光PCR法)(注册证号:国食药监械(准)字2013第3400175号)以及Sanger测序方法。考核试剂与对比方法检测结果不一致的样本或对比方法不能具体分型的样本,采用Sanger测序方法进行序列测定。
本临床试验共检测出963例突变阳性样本,阳性率为66.0%,包括EGFR基因中343例L858R突变阳性、43例T790M突变阳性、336例Exon19Deletion突变阳性、8例S768I突变阳性;KRAS基因中47例G12V突变阳性、6例G12S突变阳性、30例G12C突变阳性、1例G12R突变阳性、20例G12D突变阳性、5例G12A突变阳性、7例G13D突变阳性;ALK基因中139例ALK基因重排(融合)阳性;BRAF基因中26例V600E突变阳性。
与对比方法的研究结果显示,考核试剂的定性检测结果阳性符合率为98.6%(95%CI97.7%-99.3%),阴性符合率为94.0%(95%CI91.6%-95.9%),总符合率为97.0%(95%CI96.0%-97.8%),采用卡方检验进行统计学分析,卡方检验:p-value=1,两组检测结果无差异,显示二者具有较好的检测一致性。
在1460例样本中,两种方法检测结果不一致的样本共45例,15例样本sanger测序方法的检测结果与考核试剂检测结果一致,15例样本考核试剂NGS检出突变位点不在对比方法检测范围内,15例样本疑为不同方法检测差异引起的不一致。
(二)伴随诊断比较研究
1.EGFR基因与已上市伴随诊断试剂盒的比较研究
在上海市胸科医院、中国医学科学院肿瘤医院共2家临床机构入组样本中选择部分样本进行与已上市的伴随诊断试剂“cobas®EGFRMutationTestv2”的对比研究。本次对比研究共检测232例福尔马林固定的石蜡包埋的非小细胞肺Ca组织样本,NGS检测突变阳性137例(L858R突变阳性66例、T790M突变阳性38例、19del突变阳性67例、S768I突变阳性1例)、突变阴性95例。与cobas检测结果相比,有4例不一致样本。经统计分析,EGFR基因NGS检测结果为:L858R突变定性检测结果阳性符合率为100.0%(95%CI94.5%-100.0%),阴性符合率为99.4%(95%CI96.7%-100.0%),总符合率为99.6%(95%CI97.6%-100.0%);T790M突变定性检测结果阳性符合率为100.0%(95%CI90.3%-100.0%),阴性符合率为99.0%(95%CI96.4%-99.9%),总符合率为99.1%(95%CI96.9%-99.9%);19del突变定性检测结果阳性符合率为98.5%(95%CI92.1%-100.0%),阴性符合率为100.0%(95%CI97.8%-100.0%),总符合率为99.6%(95%CI97.6%-100.0%);S768I突变定性检测结果阳性符合率为100.0%(95%CI2.5%-100.0%),阴性符合率为100.0%(95%CI98.4%-100.0%),总符合率为100.0%(95%CI98.4%-100.0%);结果显示NGS检测EGFR基因定性检测结果阳性符合率为99.3%(95%CI95.9%-100.0%),阴性符合率为96.9%(95%CI91.2%-99.4%),总符合率为98.3%(95%CI95.6%-99.5%),采用卡方检验进行统计学分析,卡方检验:p-value=1,两组检测结果无差异,显示二者具有较好的检测一致性。不一致样本为NGS检出阳性,cobas检出阴性,其测序丰度均较低。
2.ALK基因与已上市伴随诊断试剂盒的比较研究
对四川大学华西医院、上海市胸科医院、中国医学科学院肿瘤医院、复旦大学附属肿瘤医院、上海市肺科医院共5家临床机构的入组样本均进行与已上市批准的伴随诊断试剂“ALK基因重组检测试剂盒(荧光原位杂交法)”的对比研究。本次对比研究共检测1460例样本,与其相比,结果显示NGS检测ALK基因重排(融合)定性检测结果阳性符合率为95.7%(95%CI91.0%-98.4%),阴性符合率为99.7%(95%CI99.2%-99.9%),总符合率为99.3%(95%CI98.7%-99.7%),采用卡方检验进行统计学分析,卡方检验:p-value=1,两组检测结果无差异,显示二者具有较好的检测一致性。2例不一致样本经sanger测序方法确认,全部与NGS结果一致。
(三)TKI药物疗效相关的回顾性临床研究
基于上述两项临床研究结果,为进一步验证该产品伴随诊断性能,申请人在四川大学华西医院、上海市胸科医院、中国医学科学院肿瘤医院、复旦大学附属肿瘤医院、上海市肺科医院共5家临床试验机构进行了EGFR-TKI、ALK-TKI治疗的回顾性疗效分析研究,共入组有效病例86例。
1.吉非替尼片(易瑞沙)药效相关研究申请人对部分经考核试剂检测为EGFR敏感突变阳性样本的患者进行了吉非替尼片(易瑞沙)治疗的回顾性疗效分析,纳入29例晚期非小细胞肺Ca有效病例的石蜡包埋组织样本。受试者用药前样本靶点检测结果显示为EGFR敏感突变阳性(21号外显子L858R突变阳性或19号外显子缺失突变阳性),随后服用吉非替尼片(易瑞沙)治疗,22例临床评估部分缓解,7例评估疾病稳定,临床用药客观缓解率为75.9%(95%CI56.5%-89.7%)、疾病控制率为100%(95%CI88.1%-100.0%),与既往药物临床试验客观缓解率范围基本相符。且受试者用药前样本经考核试剂检测,结果均显示为EGFR敏感突变阳性(L858R突变阳性或19号外显子缺失突变阳性),与临床既往分子检测结果一致。
2.盐酸埃克替尼片(凯美纳)药效相关研究申请人对部分经考核试剂检测为EGFR敏感突变阳性样本的患者进行了盐酸埃克替尼片(凯美纳)治疗的回顾性疗效分析,纳入21例晚期非小细胞肺Ca有效病例的石蜡包埋组织样本。受试者用药前样本靶点检测结果显示为EGFR敏感突变阳性(21号外显子L858R突变阳性或19号外显子缺失突变阳性),随后服用盐酸埃克替尼片(凯美纳)治疗,18例临床评估部分缓解,3例评估疾病稳定,临床用药客观缓解率为85.7%(95%CI63.7%-97.0%)、疾病控制率为100%(95%CI83.9%-100.0%),与既往药物临床试验客观缓解率范围基本相符。且受试者用药前样本经考核试剂检测结果均显示为EGFR敏感突变阳性(L858R突变阳性或19号外显子缺失突变阳性),与临床既往分子检测结果一致。
3.克唑替尼胶囊(赛可瑞)药效相关研究申请人对部分经考核试剂检测为ALK重排(融合)阳性样本的患者进行了克唑替尼胶囊(赛可瑞)治疗的回顾性疗效分析,纳入13例晚期非小细胞肺Ca有效病例的石蜡包埋组织样本。受试者用药前样本靶点检测结果显示13例均为ALK基因重排(融合)阳性,随后服用克唑替尼胶囊(赛可瑞)治疗,10例临床评估部分缓解,2例评估疾病稳定,1例评估疾病进展,临床用药客观缓解率为76.9%(95%CI46.2%-95.0%)、疾病控制率为92.3%(95%CI64.0%-99.8%),与既往药物临床试验客观缓解率范围基本相符。且受试者用药前样本经考核试剂检测结果均显示为ALK基因重排(融合)阳性,与临床既往分子检测结果一致。
4.甲磺酸奥希替尼片(泰瑞沙)药效相关研究申请人对部分经考核试剂检测为EGFRT790M突变阳性样本的患者进行了甲磺酸奥希替尼片(泰瑞沙)治疗的回顾性疗效分析,纳入13例晚期非小细胞肺Ca有效病例的石蜡包埋组织样本。9例受试者用药前样本靶点检测结果显示为EGFR基因T790M突变阳性、余4例不详,随后均按照AZD9291的临床试验要求服用甲磺酸奥希替尼片(泰瑞沙)后,11例临床评估部分缓解,2例评估疾病进展,临床用药客观缓解率为84.6%(95%CI54.6%-98.1%)、疾病控制率为100%(95%CI75.3%-100.0%),与既往药物临床试验客观缓解率范围基本相符。且受试者用药前样本经考核试剂检测结果均显示为EGFRT790M突变阳性(部分合并L858R突变阳性或19号外显子缺失突变阳性),与临床既往分子检测结果一致。
5.盐酸厄洛替尼片(特罗凯)药效相关研究申请人对部分经考核试剂检测为EGFR敏感突变阳性样本的患者进行了厄洛替尼片(特罗凯)治疗的回顾性疗效分析,纳入8例晚期非小细胞肺Ca有效病例的石蜡包埋组织样本。受试者用药前样本靶点检测结果显示为EGFR敏感突变阳性(21号外显子L858R突变阳性或19号外显子缺失突变阳性),随后服用盐酸厄洛替尼片(特罗凯)治疗,6例临床评估部分缓解,2例评估疾病稳定,临床用药客观缓解率为75.0%(95%CI34.9%-96.8%)、疾病控制率为100%(95%CI63.1%-100.0%)。且受试者用药前样本经考核试剂检测结果均显示为EGFR敏感突变阳性(L858R突变阳性或19号外显子缺失突变阳性),与临床既往分子检测结果一致。但因该部分有效样本量未能达到预期统计学要求,未能进行具有统计学意义的临床研究分析,故本次临床研究中未明确盐酸厄洛替尼片(特罗凯)与本产品伴随关系。
6.其他
申请人进行的TKI治疗的回顾性疗效分析中,另有2例受试者因未能提供服用TKI靶向药物的名称,未纳入统计。综上所述,该产品临床试验资料对产品的临床性能进行了较全面研究,临床试验符合要求。
四、风险分析及说明书提示
参照“YY/T0316-2016医疗器械风险管理对医疗器械的应用”标准,对该产品进行风险分析。经综合评价,人EGFR/ALK/BRAF/KRAS基因突变联合检测试剂盒(可逆末端终止测序法)的受益和风险总结如下:
本试剂盒检测结果会受到样本来源、样本采集过程、样本质量、样本运输条件、样本预处理等因素影响,同时也受到样本DNA提取质量、实验操作、实验环境等限制,导致可能得出假阳性或假阴性的检测结果。使用者须了解检测过程中可能存在的潜在风险及检测的局限性。
本试剂盒用于非小细胞肺Ca(NSCLC)患者经福尔马林固定的石蜡包埋(FFPE)的组织样本中EGFR/ALK/BRAF/KRAS基因变异的定性检测。不合理的样本采集、转运、处理以及用不满足说明书中【样本要求】的FFPE组织样本提取得到的DNA进行检测,会导致假阳性或假阴性结果,请严格按照产品说明书中【样本要求】及【检验方法】的要求操作。同时由于肿瘤组织可能存在较大异质性,不同部位取样可能会得到不同的检测结果。
本试剂盒阴性的检测结果不能完全排除靶基因突变的存在,样本中肿瘤细胞过少、过度降解、突变类型不在试剂盒检测范围内或扩增反应体系中靶基因浓度低于检测限亦可造成假阴性结果。
本试剂盒在检测过程中涉及基因扩增,在非可控的实验室操作可能由于环境中气溶胶的存在导致结果不可靠,同时PCR操作过程中气溶胶的泄露可能会导致设备甚至实验室的污染。因此,请在可控的实验室进行检测操作,操作人员需根据《医疗机构临床基因扩增管理办法》进行专业培训,非专业的操作及操作不当会影响检测质量。
本试剂盒为基于二代测序平台的多基因位点的伴随诊断产品,检测过程主要包括FFPE样本中DNA提取、文库制备、杂交捕获、测序及数据分析等步骤。为确保检测全流程的质量得到有效控制,在产品设计开发阶段对样本提取试剂、文库质控试剂及测序试剂进行了全流程匹配性验证,为了确保检测结果的准确性,配套开发了测序数据分析及结果判读的生物信息分析软件。请使用本试剂盒推荐使用的配套试剂盒及软件进行检测,本试剂盒未对其他配套试剂盒及软件进行对比验证。
通过环境控制、生产监控、成品检验和增加说明书警示内容等防范措施,对该产品的已知和可预见的安全风险进行控制和降低,剩余风险可以被控制在验收准则规定的可接受范围内,同时没有带来新的危害与安全风险。在目前认知水平上,认为该产品上市带来的获益/受益大于风险。
尽管目前认为该产品的受益大于风险,但为保证用械安全,基于对主要剩余风险的防控,已在产品说明书中提示以下信息:
1.适用范围:用于定性检测非小细胞肺Ca(NSCLC)患者经福尔马林固定的石蜡包埋(FFPE)的组织标本中EGFR/ALK/BRAF/KRAS基因变异。其中,EGFR基因中:19号外显子缺失(19del)、L858R点突变用于吉非替尼、埃克替尼的伴随诊断检测,T790M点突变用于奥希替尼的伴随诊断检测;ALK基因中:ALK重排(融合)用于克唑替尼的伴随诊断检测,其它稀有突变本产品检测试剂可以检出,但EGFR/ALK/BRAF/KRAS相关肿瘤药物安全性和有效性尚未确定。
2.警示及注意事项:产品说明书中介绍了该产品检验方法的局限性及使用中的注意事项。